
题目列表(包括答案和解析)
4.根据所学知识,下列有关胶体的说法中正确的是英才苑
A.将饱和的FeCl3溶液加热至沸,制得Fe(OH)3胶体
B.将磁性物质制成胶体离子作为药物的载体,可在磁场作用下送到病灶
C.化工生产上可利用丁达尔效应将油漆粒子均匀地沉积在镀件上
D.将蔗糖溶于溶解在酒精中,则可形成胶体
3.下列有关说法正确的是
A.CaCl2、聚苯乙烯、HD均为化合物
B.CH2O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
2.广东北江曾发生严重的水体镉污染事件,专家确定用1200吨的聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)(3-n)/2]m,n<5,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法正确的是
A.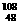 Cd核素原子中的电子数为48,中子数为60
Cd核素原子中的电子数为48,中子数为60
B.含镉废电池含镉量很少,无需进行回收处理
C.PFS是铁显十2价的一种碱式硫酸盐聚合物
D.实验室可通过FeSO4溶液水解和聚合制PFS
1.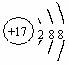 下列化学用语表达正确的是
下列化学用语表达正确的是
A.S2-的结构示意图: B.乙炔的结构简式CHCH
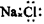 C.NaCl的电子式:
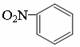
D.硝基苯的结构简式:
C.NaCl的电子式:
D.硝基苯的结构简式:
26.(12分)室温下,CO2和NO的混合气体共10L,其中NO占的体积分数为a。将此混合气体通过足量的Na2O2之后,所得气体再用排水法收集。讨论当a取不同范围的值时,最终收集到的气体的成份及其体积。
25.(12分)将一定质量的金属钠和一定质量的氧气在一密闭容器中加热反应,冷却后取残留固体加入过量水中,CY放出0.336L气体(标况),将此气体点燃恢复到标况下无气体剩余。所得的水溶液加入0.5mol·L-1的稀硫酸80mL,恰好溶液呈中性。求:
(1)与氧气反应前金属钠的质量;
(2)钠与氧气反应的残留固体的成分及质量。
24.(6分)多硫化物S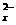 (x的数值在2-6之间)在碱性溶液中被BrO
(x的数值在2-6之间)在碱性溶液中被BrO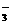 氧化为SO
氧化为SO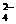 ,而BrO
,而BrO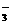 被还原为Br-,在反应中消耗BrO
被还原为Br-,在反应中消耗BrO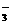 和OH-的物质的量之比为2 : 3,则 ( )
和OH-的物质的量之比为2 : 3,则 ( )
(1)X的值为 ;
(2)反应的离子方程式为 ;
(3)此反应的还原剂与氧化剂物质的量之比是 。
23.(12分)从固体物质A开始,可以发生如下框图所示的一系列变化:
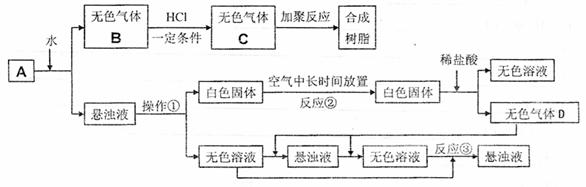
回答下列问题:
(1)A的化学式是 。
(2)在实验室中收集气体B的方法是 。
(3)操作①的名称是 ,在操作①中所要使用的玻璃仪器有 (填名称)。
(4)写出反应②和反应③的化学方程式:
反应②: ;
反应③: 。
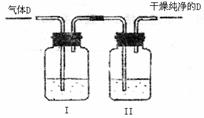 (5)在实验室中,如要获得干燥纯净的气体D,
(5)在实验室中,如要获得干燥纯净的气体D,
可以将它通过如图的装置,其中瓶I中盛
放的试剂 ,瓶II中盛放的试剂
剂是 ,收集干燥气体D的方
法是 。
22.(8分)在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)
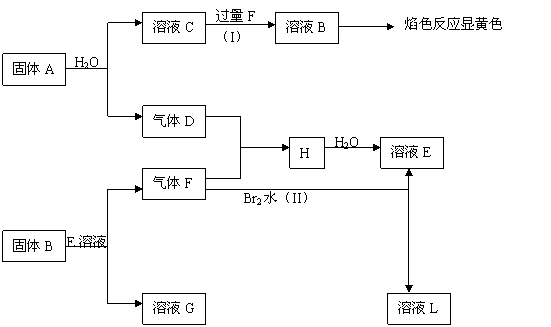
请回答:
(1)固体A是(写化学式) ;
(2)反应(I)的离子方程式 ;
(3)反应(II)的化学方程式 ;
(4)在标准状况下,H呈 态(填固、液或气),它和溶液B反应的离子方程式是
。
21.(13分)硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
|
(Ⅱ)粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
(Ⅲ)SiHCl3与过量H2在1000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点为33.0℃)中含有少量SiCl4(沸点为57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用方法的名称为 。
(3)用纯SiHCl3与过量纯H2反应制备纯硅的装置如下(此装置气密性已检验,药品已添加,且热源及夹持装置略去):
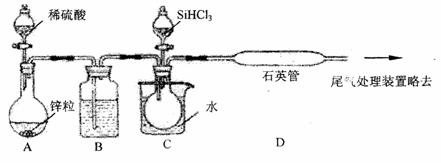
①装置B中的试剂号 ,它的作用是 和 。
②A和C装置中都含有分液漏斗,实验时应先滴入 (填A或C)处分液漏斗内的液体药品,目的是 。
③装置C中的烧瓶需要水浴加热,此处的加热温度需高于 ℃。装置D不能采用普通玻璃管,且需用酒精喷灯加热,此处的加热温度需高于 ℃。实验时应先加热 (填C或D)处,原因是 。
④为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及控制好 ,若该因素不合要求,应怎样改进?具体的操作是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com