
题目列表(包括答案和解析)
4.请根据图示,回答问题:
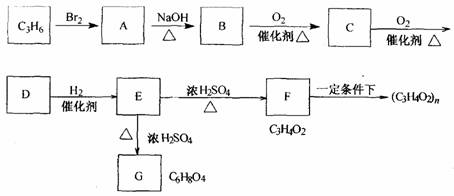
(1)请写出下列转化的方程式并指出反应类型。
①C3H6 →A:__________________________________
②E→G:_____________________________________
 O
O
(2)请设计实验,证明C中含有-C-H:____________________。
(3)F中含有的官能团有①_______________、②_____________;
请设计实验证明:
①_______________________;②____________________________。
3.在一定条件下,烯烃、炔烃通过臭氧化并经锌和水处理可发生以下反应:
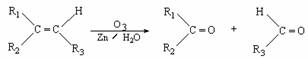
R1-C≡C-CH=CH-R2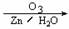 R1COOH + HOOC-CHO + R2CHO
R1COOH + HOOC-CHO + R2CHO
1mol CH3-C≡C-CH= CH-C≡C-CH=CH-CH3通过臭氧化并经锌和水处理可生成1mol A、a mol HOOC-CHO和1molB(A的相对分子质量大于B相对分子质量)。
(1)a= ;HOOC-CHO与H2在一定条件下反应的产物结构简式为: ;
(2)液体B的燃烧热为b kJ·mol-1。试写出B燃烧的热化学方程式:
(3)有机物C与A相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则C的结构简式为_____________;C与新制Cu(OH)2悬浊液在加热条件下发生的化学反应方程式为 ;
(4)烯烃C8H16通过臭氧化并经锌和水处理只得到一种产物,该烯烃可能的结构有 种。
2.现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
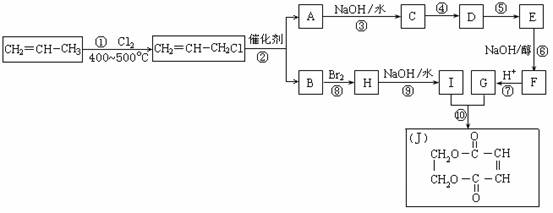
请按要求填空:
(1)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是______________________________________________,物质E的结构简式是_______________________。
(4)反应⑩的化学方程式是___________________________________________。
1.由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如下:
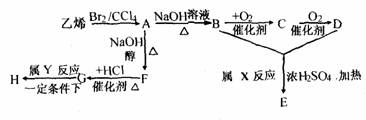
请回答下列问题:
(1)写出结构简式:A___________,P__________,C____________。
(2)反应类型:X___________,Y__________。
(3)写出化学反应方程式:
A→B_____________________________。
G→H_____________________________。
(4)若环状酯E在NaOH溶液中共热,则发生反应的化学方程式为
___________________________________。
6.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是………………………………………………………………………( C )
A.HF B.H3O+ C.NaH D.H2O
解析:ⅦA族的元素与钠可形成NaX。
5.制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使循环温度降低,达到制冷目的。人们曾采用过乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 CH4 > NH3 >H2O 、HF,第三周期SiH4 >PH3 >H2S >HCl。
(2)化合物的毒性:PH3 > NH3;H2S > H2O;CS2 > O2 ,CCl4 >CF4(选填>、<或=)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新的制冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的制冷剂氟利昂CF2Cl2 终于诞生了,其他类似的还可以是 CFCl3(或CF3Cl) 。
(4)然而,这种制冷剂造成了当今的某一环境问题是 使大气臭氧层出现空洞 ,但求助于周期表中元素及其化合物的 A (填写字母)变化趋势来开发制冷剂的科学思维方法是值得借鉴的。
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
A.①②③ B.②④⑤ C.②③④
解析:
(1)根据元素周期律,非金属性越强,氢化物的稳定性越大。从题中的信息,知道第三周期的氢化物易燃性顺序为SiH4 > PH3 > H2S > HCl,因此很容易推出第二周期的氢化物的易燃性顺序为CH4 > NH3 > H2O、 HF。
(2)根据已知化合物的毒性:PH3 >NH3 ,CCl4 >CF4,自己创造规律,得出“相同类型的化合物,相对分子质量越大,其化合物的毒性也越大”的结论,然后应用此规律,得出H2S >H2O ;CS2 > O2 。
4.下列叙述正确的是……………………………………………………………………( C )
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
解析:同周期元素,从ⅠA → ⅦA(即从左到右)原子半径逐渐减小,因此A选项不对;氧族元素(ⅥA)从上到下,其半径越来越大,越容易失去电子,即非金属性越来越弱,金属性越来越强,B选项不对;在室温下,稀有气体均为单质气体,C选项正确;氯为ⅦA族元素,其单原子离子Cl-为负一价,D选项不对。
3.根据中学化学教材所附元素周期表判断,下列叙述不正确的是……………… ( C )
A.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
B.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
2.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是………………………………………………………………………………( C )
A.原子半径A > B > D > C B.原子序数d > c > b > a
C.离子半径C>D>B>A D.单质的还原性A > B > D > C
解析:因aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则A、B、C、D四种元素在周期表中的相对位置为: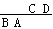 ,根据元素周期律有:原子序数a > b > d > c,原子半径B > A > C
> D,离子半径C > D > B > A,单质的还原性B > A > C > D,故正确的选项为C项。
,根据元素周期律有:原子序数a > b > d > c,原子半径B > A > C
> D,离子半径C > D > B > A,单质的还原性B > A > C > D,故正确的选项为C项。
1.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能的是…………………………………………………………………………………( B )
A.X+2 B.X+4 C.X +8 D.X+18
解析:本题考查学生对元素周期表中各周期元素种数的识记能力。由于一、二、三……周期元素种数分别为2、8、8、18、18、32,故同一主族元素的原子序数之差应为以上数据或以上数据之间的和,当甲的原子序数为X时,乙的原子序数Z可能为:Z-X = 2 Z = x + 2;Z-X = 8
Z = x + 2;Z-X = 8 Z = x + 8;Z-X = 2 + 8
Z = x + 8;Z-X = 2 + 8  Z = x + 10; Z-X = 18
Z = x + 10; Z-X = 18 Z = x + 18,但绝对不会出现Z = x + 4,故本题正确选项为B。
Z = x + 18,但绝对不会出现Z = x + 4,故本题正确选项为B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com