
题目列表(包括答案和解析)
17.(12分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
⑴ 将尾气通人氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:___________________________、___________________________。
⑵ 在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。① 导致溶液温度降低的原因可能是______________________________;② 析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为___________________________;③ 生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是___________________________。
⑶ 能用于测定硫酸尾气中SO2含量的是___________________。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
16. (10分)氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂。以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图。
(10分)氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂。以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图。
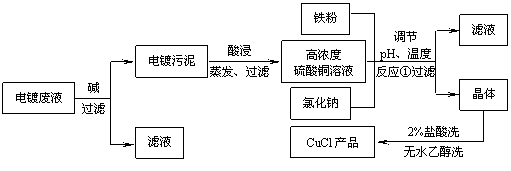

 下图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系。
下图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系。

 试回答下列问题:
试回答下列问题:
 ⑴当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为____________________________。
⑴当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为____________________________。
 ⑵由反应①制备CuCl时的最佳pH在______________左右。
⑵由反应①制备CuCl时的最佳pH在______________左右。
 ⑶已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有_____________的特性。
⑶已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有_____________的特性。
 ⑷反应①中1 mol铁粉完全反应转移2 mol电子,该化学反应的方程式为_________________________________________。如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则离子方程式为____________________________________。
⑷反应①中1 mol铁粉完全反应转移2 mol电子,该化学反应的方程式为_________________________________________。如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则离子方程式为____________________________________。
15.(12分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
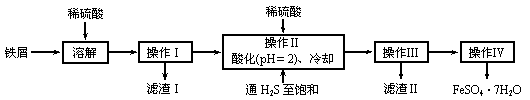
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
⑴检验所得绿矾晶体中是否含有Fe3+的实验操作是____________________________。
⑵操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是______________________________;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②____________________________。
⑶操作IV的顺序依次为:____________、结晶____________。
⑷操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②________________________________。
⑸测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①计算上述样品中FeSO4·7H2O的质量分数为_________________________。
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有__________________________________;__________________________________。
14.下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH 、CH3COONa 混合溶液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
B.在0.1 mol·L―1 NaHSO3溶液中有c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(H2SO3)
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D.物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:
3c(H2CO3)+2c(H+)+c(HCO3-)=2c(OH-)+c(CO32-)
非选择题
13.T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的转化率与时间的关系如图2所示。则下列结论正确的是
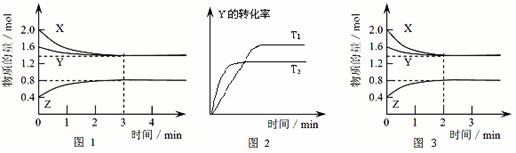
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
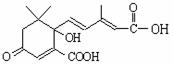
12.利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是
|

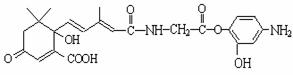
X Y
A.X结构中有2个手性碳原子
B.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
C.X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐。
D.1 molX与足量NaOH溶液反应,最多消耗5 mol NaOH ,1 molY最多能加成4 molH2
,1 molY最多能加成4 molH2
11.下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO- 3
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-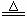 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO- 3
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+Fe(OH)3=FeO2- 4+3Cl-+H2O+4H+
10.下列化学实验事实及其解释都正确的是
A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性
B.久置的酚酞试液有白色沉淀(未变质),加入少量酒精,沉淀消失,说明酚酞易溶于酒精
C.硫酸铜溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀为CuI2
D.在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,无红色沉淀,说明淀粉未水解
9. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
 选项 选项 |
W |
X |
||
|
A |
盐酸 |
Na2CO3溶液 |
||
|
B |
Cl2 |
Fe |
||
|
C |
CO2 |
Ca(OH)2溶液 |
||
|
D |
NH3·H2O |
|
8.下列化学实验能达到目的的是
A.用激光笔检验某KI溶液中是否溶有淀粉
B.加入适量溴水后过滤,可除去苯中的少量苯酚
C.向碘水中加入苯或酒精,均可从碘水中萃取碘
D.向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp (AgI)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com