
题目列表(包括答案和解析)
11. 下列有关水溶液中的离子问题的叙述中正确的是
A.pH=12的氨水和pH=2的盐酸溶液等体积混合,c(Cl-)> c(NH4+)>c(H+)>c(OH-)
B.将pH=11的氨水溶液稀释后,恢复至原温度,pH和Kw均减小
C.向一定量的醋酸溶液中逐滴加入物质的量浓度相同的氢氧化钠溶液,直至氢氧化钠过量,在实验过程中水的电离程度的变化趋势是先小后大
D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
10. 下列实验中,能够达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
在Na2SO3溶液中加入HNO3酸化的Ba(NO3)2
,产生白色沉淀 |
检验Na2SO3是否变质 |
|
B |
将某气体通入品红溶液中,品红褪色 |
证明该气体是SO2 |
|
C |
用洁净的玻璃棒蘸取NaOH溶液,点在湿润的pH试纸上,与标准比色卡对照 |
测定NaOH溶液的pH |
|
D |
在两支试管中各加入4 mL 0.01
mol/L的KMnO4 酸性溶液,再分别加入0.1 mol/L H2C2O4 溶液2 mL、0.2 mol/L H2C2O4
溶液2 mL, 分别记录溶液褪色所需时间 |
探究相同条件下,溶液浓度对反应速率的影响 |
9. 下列有关生活中常见有机物的说法中正确的是
A.乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液、酸性高锰酸钾溶液等多种方法鉴别
B.油脂都不能使溴水褪色
C.煤油可由石油催化裂化及裂解得到,可用于保存金属钠
D. 因为葡萄糖在糖类结构中最简单,因此它是一种单糖
8. NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式是
MnO4- + NO2- + H+ → Mn2+ + NO3- + H2O(未配平)。下列叙述中不正确的是
A.该反应中NO2- 是还原剂 B.反应过程中溶液的pH 减小
C.生成1 mol NaNO3时消耗0.4 mol KMnO4
D. 该反应可说明氧化性MnO4- >NO3-
7. 下列说法中正确的是
A.在滴加石蕊试液显红色的溶液中,Fe3+、Cl-、NH4+、SCN- 可以共存
B.常温常压下,100 mL 0.5 mol/L醋酸溶液中,醋酸分子的数目小于0.05 mol
C.根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体
D. 利用溶解性的不同,可用酒精将碘水中的碘萃取出来
6. 化学与环境、科学、技术密切相关。下列有关说法中正确的是
A.可使用填埋法处理未经分类的生活垃圾 B.合成纤维和光导纤维都是有机高分子化合物
C.光化学烟雾的形成与汽车尾气中的氮氧化物有关
D. 纯铁比碳素钢更容易生锈
21.(12分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
⑴基态Ni原子的核外电子排布式为______________________________。
⑵金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式为______________________。
⑶很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③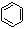
 、④HCHO等,其中碳原子采取sp2杂化的分子有_____________(填物质序号),预测HCHO分子的立体结构为__________________形。
、④HCHO等,其中碳原子采取sp2杂化的分子有_____________(填物质序号),预测HCHO分子的立体结构为__________________形。
⑷NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为____________________;Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑸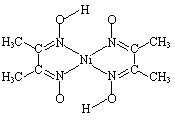 金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
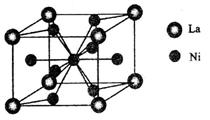
⑹丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
20.(10分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3kJ/mol
SO2Cl2(l) △H=-97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是_________(用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
⑵已知20℃时,AgCl的溶解度为0.00015g,Ag2SO4的溶解度为0.796g。则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______________。
⑶300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃的合成SO2Cl2反应的平衡常数为_________________。
⑷将⑶所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量(写出计算过程)。
19.(12分)阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
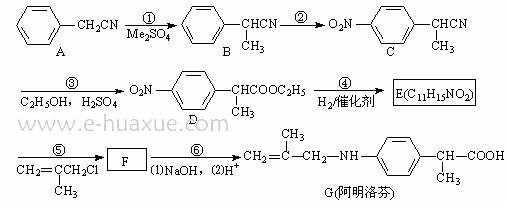
⑴反应①为取代反应,该步反应物Me2SO4中的“Me”表示_______________。
⑵写出F的结构简式_______________________。
⑶反应③可以看成是两步反应的总反应,第一步是氰基(-CN)的完全水解反应生成羧基(-COOH), 请写出第二步反应的化学方程式_________________。
⑷化合物E满足下列要求的同分异构体有_________________个。
①含有基团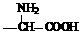 ②含有对位二取代苯环
②含有对位二取代苯环
⑸阿司匹林也是一种抗炎镇痛药,可由水杨酸(邻羟基苯甲酸)和醋酸酐合成。请以邻羟基苯甲醇为有机原料设计合理步骤合成水杨酸。(已知:苯酚易被氧化而苯酚钠难被氧化。)
18.(10分)二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
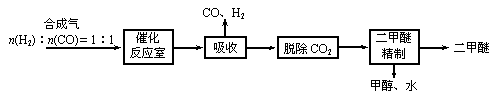 Ⅰ.工业制备二甲醚的生产流程如下:
Ⅰ.工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0-10.0Mpa,温度230-280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
△H=-90.7kJ/mol
CH3OH(g)
△H=-90.7kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
⑴甲烷氧化可制合成气:CH4(g)+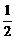 O2(g)
O2(g) CO(g)+2H2(g) △H=-35.6kJ/mol,该反应是_____________反应(填“自发”或“非自发”)。
CO(g)+2H2(g) △H=-35.6kJ/mol,该反应是_____________反应(填“自发”或“非自发”)。
 ⑵催化反应室中总反应3CO(g)+3H2(g)
⑵催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=________________________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_____________1.0(填“>”、“<”或“=”)
CH3OCH3(g)+CO2(g)的△H=________________________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_____________1.0(填“>”、“<”或“=”)
⑶上述流程中,可循环使用的物质有___________。
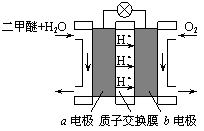
Ⅱ.右图为绿色电源“直接二甲醚燃料电池”
的工作原理示意图。
⑴b电极是_____________极。
⑵a电极的反应式为_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com