
题目列表(包括答案和解析)
17.测得某一溶液中仅含有Na+、Mg2+、Cl-、SO42--四种离子,其中Na+和Mg2+的个数比为4∶5,则Cl-和SO42-的个数比可能为①8∶3 、 ②1∶3 、 ③4∶1 、 ④3∶2 ,其中正确的是
A.只有① B.只有①②④ C.只有②④ D.①②③④
16.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O2+2H2O=4NaOH+O2↑
B.CaC2+2H2O→Ca(OH)2+CH CH↑
CH↑
C.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
D.NH4Cl+NaOH加热NaCl+H2O+NH3↑
15.常温下,有甲、乙两份体积均为1L浓度为0.1mol/L的氨水,其pH为11。
⑴甲用蒸馏水稀释100倍后,溶液的pH将为 ;
⑵乙与等体积,浓度为0.2mol/L的HCl混合,则混合溶液中,n(NH4+)+n(H+)-n(OH-)= mol
正确的答案组合是
A.9~11之间 0.1 B.9~11之间 0.2
C.12~13之间 0.2 D.13 0.1
14.目前工业生产H2O2的一种新方法的生产过程中,会生成一种中间产物,其结构简式为: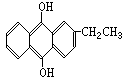 。有关该物质的说法正确的是
。有关该物质的说法正确的是
A.它属于芳香族化合物 B.它是苯的同系物的含氧衍生物
C.它可发生消去反应 D.它可与NaOH溶液反应
13.温度不变时,在盛有饱和碳酸钠溶液的烧杯中,插入石墨做电极,通直流电一段时间后,下列说法不正确的是
A.碳酸根离子的水解程度不变
B.钠离子和碳酸根离子的物质的量浓度的比值将变小
C.溶液的pH不发生变化
D.溶液的浓度逐渐增大,有一定量晶体析出
12.下列离子方程式书写正确的是
A.将少量AgNO3溶液滴入氨水中
Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
B.将少量SO2通入NaClO溶液中
SO2+2ClO-+H2O=SO32-+2HClO
C.大理石上泼上醋酸
CaCO3+2H+=Ca2++H2O+CO2↑
D.含有0.1molFeI2的溶液中通入标准状况下2.24LCl2
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
11.用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.在反应CaO+3C高温CaC2+CO↑中生成1molCO,电子转移数为3 NA
B.常温时,2L1mol/L的甲酸溶液中,所含分子总数小于2NA
C.1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
D.1molNH2-中含电子数为10 NA
10.某温度下,反应2NO2 N2O4;△H<O。在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变条件的可能有
N2O4;△H<O。在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变条件的可能有
A.保持容器容积和温度不变,向容器内补充了NO2
B.保持容器容积和温度不变,向容器内补充了N2O4
C.保持温度压强不变,向容器内补充了N2
D.保持容器的容积不变,升高了温度
9.用脱脂棉包住0.2gNa2O2粉末,放在石棉网上,在脱脂棉上滴加几滴水;可以观察到脱脂棉剧烈燃烧起来。由实验现象所得出的结论正确的是
A.Na2O2与H2O反应是一个放热反应
B.Na2O2与H2O反应中有氧气生成
C.Na2O2与H2O反应中有氢氧化钠生成
D.Na2O2与H2O反应中有中间产物H2O2生成
8.甲醛、乙酸和2-羟基丙醛组成的混合物中0元素的质量分数为37%,则其中H元素的质量分数为
A.9% B.12% C.16% D.20%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com