
题目列表(包括答案和解析)
25.水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO3-的水所形成水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到11.82g沉淀。
⑴ 通过计算确定A中是否含有碳酸镁;
⑵ 5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量。(空格不一定填滿)
|
各成分的化学式 |
|
|
|
|
|
各成分物质的量 |
|
|
|
|
24.在101.3kPa,482K条件下,正癸醛以及分子中碳原子数比它少的醛均为气态,以下变化中,最初与最终情况均维持这种条件。A、B、C3种饱和一元醛分子中碳原子依次增加相同的个数,取等体积的3种醛,分别跟28mL氧气(过量)混合,点燃充分反应发现:A和氧气反应前后的总体积不变;B和氧气反应前后体积增加3mL,C和氧气反应后总体积为反应前的1.2倍。试求:
⑴A的分子式。
⑵原任意一种醛的体积及B、C的分子式。
23.资料:烯烃在一定条件下可被强氧化剂氧化成醛,例如:
RCH=CHR′
 RCHO + R′CHO
RCHO + R′CHO
某同学从A出发研究下列所示转化关系:

(1)A的化学式为___________,E的结构简式__________________________________;
(2)A是一种可以作为药物的有机物,将A在一定条件下氧化可以得到两种有机酸X和Y,X属于芳香族化合物,它在食品保存及染料、药物生产中均有重要作用,则X的结构简式为:_________________________________;
(3)若B的一种同分异构体与到FeCl3溶液呈现紫色,且该同分异物体苯环上的同分异构体只有一种,则符合该条件的同分异物体是____ ___。
(4)在上述转化关系中设计设计步骤A→F的目的是________________ ____;
G→H的化学反应类型是 。
(5)在研究过程中该同学发现从A合成E,有一条比上述简便的方法,请你帮助他完成A→…→E的反应流程图(有机物用结构简式表示,必须注明反应条件)。
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:

 甲苯 ……
E
甲苯 ……
E
22.1 mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1 molB和1 molC。B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中C原子数相同,且Mr(B)=Mr(C)+2。
⑴ C的分子式为 ,A的摩尔质量为 ;
⑵ B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式 ;
⑶ C有多种同分异构体,其中属于酯类的同分异构体有 种;
⑷ C分子中苯环上有两个取代基,且苯环上的一氯取代物有两种。写出A的结构简式 。
21.某校化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色黑体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)写出所形成原电池负极的电极反应式: 。
(4)欲利用此反应测定合金中铝的金属,理论上还应该测定哪些数据?请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式: 。
[实验三]取实验二的锥形瓶里的溶液10mL,向其中商加a mLC1mol·L-1NaOH之后,
改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如图所示。
据此,回答下列问题:
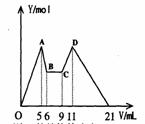 (1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体
(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体
积的两倍,则C1/C2= ;
(2)所加入NaOH溶液的体积a= mL。
20.(1)若AgC1在水中、0.01 mol·L-1 CaCl2溶液中、0.01 mol·L-1 NaCl溶液中及0.05 mol·L-1AgNO3溶液中的溶解度分别为S1、S2、S3、S4,则S1、S2、S3、S4由大到小的顺序为 。
(2)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关
性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
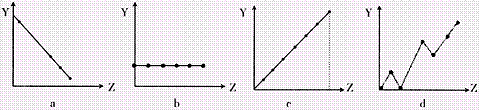
①ⅡA族元素的价电子数 ;②第3周期元素的最高化合价 ;
(3)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物的水化物的化学式为 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为 ,B的化学式为 。
③工业上制取单质M的化学方程式为 。
19.已知B、C、D、K都是气体单质,物质A的焰色呈黄色,I为4核10电子中性分子,各有关物质之间的相互反应转化关系如下图所示,反应①--⑤ 都是用于工业生产的反应。

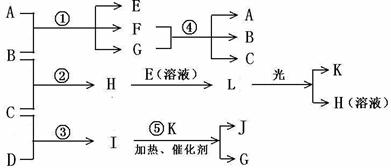
请填写下列空白:
(1)写出下列物质的化学式:B ,J 。
(2)写出下列反应的离子反应方程式:
H+E(溶液)→L ;
F+G →A+B+C 。
(3)若I与E以物质的量比1:2反应,得到F、G和二元素六核化合物M,则M的电子式是
。
(4) 反应④用于工业生产时目前采用如图示装置,该装置的优点有:
① ;
② 。
(5) 如图示装置(溶液体积为100mL), 其阴极的电极方程式是 , 标况下,当电极上产生112mL B气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。
18.(12分).碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代 号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
⑴在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
|
时间 |
起始 |
14min后 |
30min后 |
75min后 |
|
pH |
<2.0 |
=2.5 |
<3.5 |
=3.5 |
试解释排气管中放出气体的pH变化的原因。如果把排气管加长一倍,排气的pH有无变化?为什么? ,
⑵观察反应器内溶液的颜色(取上面清液观察),在沸腾1h内,溶液逐渐呈黄绿色,以后逐渐转变为淡棕黄色,1.5h后呈棕红色。解释导致颜色变化的原因。
⑶上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这是什么物质?为什么此时会有沉淀析出?
⑷铁的化合物和铝的化合物一样也可作净水药剂,此外,溶液中元素Fe还能与CN-形成特定的络合物。某溶液中同时存在Fe(CN)63-和Fe(CN)64-两种离子,H2O2可使它们相互转化,请用离子方程式表示这种转化。
酸性条件:
碱性条件:
17.“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。“烂版液”的主要成分是Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。
在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀,用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2……
⑴步骤①中控制溶液pH=8的操作是 ;步骤②中如何检验沉淀已经洗涤干净? 。
⑵步骤③中加热的目的是 ;趁热过滤的目的是 。
⑶将步骤④还缺少的操作是 ,所用的主要仪器是 。
16. 如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
A.C(I)的电极名称是负极
B.C(Ⅱ)的电极名称是阳极
C.C(I)的电极反应式是2H++2e一=H2↑
D.C(Ⅱ)的电极反应式是Cl2 +2e一=2Cl一
第Ⅱ卷(非选择题 共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com