
题目列表(包括答案和解析)
19. (10分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
(10分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在FeCl2 否___(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 是___(填“是”或“否”),你的判断依据是 气体通过浓硫酸减少4.4 8L 。
⑶写出反应④的离子反应式: AlO-+H++HO ==Al(OH__ 。
⑷请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程) 由题中信息可推得一定含有g,所以一定没题中信息可推得一定含有g含含,所以一定没有A有A
lCl 题中信息可推得一定含有g,所以一定没含有A 。
⑸把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶。往浓盐酸后,再加热浓 缩析出晶体
______________________________________________________________________ 。
18.(14分) SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下实验装置:
注:单向阀原理说明:当推注射器活塞时,①关闭,②打开;
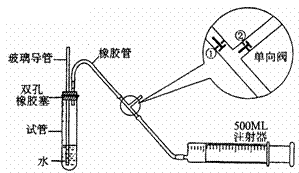 当拉注射器活塞时,①打开,②关闭。
当拉注射器活塞时,①打开,②关闭。
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后___________________(填写操作方法)时,将会看到__________(填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.0005mol·L-1的碘水1.0mL,用适量的蒸馏水稀释后再加入2-3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由_________色变为_________色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为_____________________________________________。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值(mg·m-3):一级标准:0.15 二级标准:0.50 三级标准:0.70。该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500mL)。请将下表填写完整(计算时保留2倍有效数字):
|
分 组 |
第一小组 |
第二小组 |
|
抽气次数 |
120 |
140 |
|
SO2含量/mg·m-3 |
|
|
判断该地点的空气中SO2的含量属于________(填数字)级标准,________(“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)_________________________________________。
17.(8分)(1)下列实验操作或对实验事实的叙述正确的是___________(填序号))
①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50 g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
④配制Al2(SO4)3溶液时,加入少量的稀硫酸;
⑤将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较测得该溶液的pH;
⑥中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;
(2)回答下列问题.
①某同学将甲烷气体长时间通入溴水中,溴水颜色 (填写“变深”、“变浅”、“不变”)。 其主要原因是 。
②在试管中装有四氯化碳和水两种液体,静置分层后,如果不知道哪一层液体是“水层”,试设计一种最简便的判断方法:
16.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol
Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
第Ⅱ卷(非选择题 共86分)
15.一定质量的铜和足量的硝酸反应,所放出的气体与标准状况下的氧气1.12L混合后再通入水中,恰好被完全吸收,则铜的质量为
A.3.2g B.4.8g C.6.4g D.10.8g
14.阿伏加德罗常数约为6.02×1023mol-1。下列叙述正确的是
A.1L0.1mol/L的FeCl3溶液中,H+的数目约为6.02×1015
B. 1mol金刚石中含有C-C键的数目约为6.02×1023
C. 7.8gNa2O2中含有的阴离子数目约为6.02×1022
D. 标准状况下,1L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)×6.02×1022
13.已知氧元素有16O、18O两种核素,按中学化学知识要求,下列说法正确的是
A.Na2O2与H218O反应时产生18O2气体
B.向2SO2(g)+O2(g) 2SO3(g)的平衡体系中加入18O2,结果18O只出现在产物中
2SO3(g)的平衡体系中加入18O2,结果18O只出现在产物中
C.CH3COOH和CH3CH218OH发生酯化反应时,产物中分子式为H218O
D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子
12.将饱和一元醇与饱和一元羧酸混合后,再加入浓硫酸加
热,结果只生成碳原子个数分别为4、5、6的三种酯,则下列说法不正确的是
A.若羧酸分子中的碳原子数分别为3个和4个时,则醇分子中碳原子分别为1个和2个
B.若羧酸分子中的碳原子数分别为2个和3个时,则醇分子中碳原子分别为2个和3个
C.甲酸和甲醇在混合物中不能同时存在
D.若羧酸分子中的碳原子数分别为2个和3个时,则醇分子中碳原子分别为3个和4个
11. 右图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或者增大压强。速率的变化都符合的示意图的反应是
右图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或者增大压强。速率的变化都符合的示意图的反应是
A.2SO2(g)+O2(g)  2SO3(g); △H<0
2SO3(g); △H<0
B. 4NH3(g)+5O2(g)  4NO(g)+6H2O(g); △H<0
4NO(g)+6H2O(g); △H<0
C. H2(g)+I2(g)  2HI(g); △H>0
2HI(g); △H>0
D. C(s)+H2O(g)  CO(g)+H2(g); △H>0
CO(g)+H2(g); △H>0
10.下列离子方程式中错误的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.苯酚钠溶液中通入少量CO2: -O-+CO2+H2O→
-O-+CO2+H2O→ -OH+HCO3-
-OH+HCO3-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com