
题目列表(包括答案和解析)
1. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分 子。N4分子结构如右图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分 子。N4分子结构如右图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN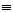 N放出942kJ根据以上信息和数据,下列说法正确的是
N放出942kJ根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体 D.1molN4气体转变为N2将吸收882kJ热量
26、(10分)某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物。根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁。
①取一高度腐蚀的干燥铁钉,称其质量为10.04g,在氮气保护下,充分加热,冷却后称得质量为8.92g。
②将①得到的残渣投入到5.00mol/L的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00mL。整个过程无气体放出。试回答下列问题:
⑴铁锈中是否含有碳酸亚铁?理由是?
⑵锈蚀的铁钉中含Fe2O3·H2O多少克?
⑶锈蚀前铁钉的质量至少多少克?

25、(8分)丁烷在一定条件下可以按两种方式裂化:C4H10→C2H6+C2H4;C4H10→CH4+C3H6,现对发生裂化反应后的裂化气(不含丁烷)进行研究。
⑴探究裂化气的热值: 已知:
|
气体 |
CH4 |
C2H6 |
C2H4 |
C3H6 |
|
燃烧热(kJ/mol) |
Q1 |
Q2 |
Q3 |
Q4 |
①若44.8L(标准状况)裂化气充分燃烧放出热量QkJ,则Q的取值范围介于: ~ (用Q1、Q2、Q3、Q4表示,下同)。
②若将44.8L气体(标准状况)缓缓通过盛有足量溴的四氯化碳溶液中,发现洗气瓶增重33.6g,则44.8L(标准状况)气体完全燃烧放出的热量Q= kJ。
⑵测量与H2加成反应后气体总体积与氢气的体积分数关系:
另取裂化气与H2混合得5L混合气体,已知其中H2的体积分数ψ(H2)=X,在一定条件下使其充分反应,反应后气体的体积为VL。请列出V与X的函数关系式。
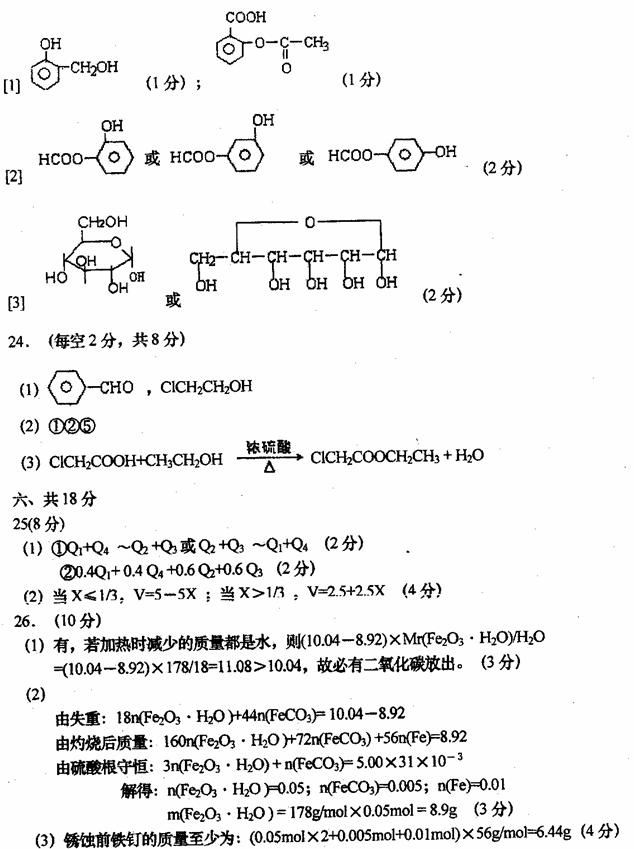
24、(8分)杨梅酯是制作冰制食品、糖果等的香料,可用A、E两种烃为原料,经如下路线合成
试回答下列问题:
⑴写出结构简式:D: ,F:
⑵上述属于取代反应的有 (选填序号)
⑶写出反应⑤的化学方程式:
23、(10分)试完成下列两小题:
Ⅰ、C1化学是指从一个碳原子的化合物(如CH4、CO、CO2、CH3OH、HCHO等)出发合成各种化学品的技术。从煤、天然气制合成气再进一步制备各种化工产品和清洁燃料,已成为当今化学工业发展的必然趋势。其中甲醇是C1化学的基础。
①CO和H2按一定比例可生成乙二醇,则n(CO)/n(H2)= (填数字)。
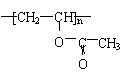 ②若汽油平均组成用CmHn表示,则合成汽油应控制n(CO)/n(H2)=
(用m、n表示)
②若汽油平均组成用CmHn表示,则合成汽油应控制n(CO)/n(H2)=
(用m、n表示)
③甲醇在一定条件下与CO、H2作用生成A,A发生加聚可生成高分子 ,写出生成A的化学方程式
Ⅱ、已知醇、醛在一定条件下能发生缩合反应,示例如下:
已知:
①1827年人们就发现有机物A,它的分子式为C13H18O7,与一分子水作用,水解生成B和C;
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6;
③C遇氯化铁溶液能发生显色反应,1molC与足量钠反应可生成1molH2;
④C在适当的条件下用适当氧化剂演化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14;
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应;
⑥D与乙酸酐[(CH3CO)2O]反应,可得到常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
⑴写出结构简式:C E
⑵写出与D互为同分异构体,含有苯环且含有酯结构的结构简式: (只需写一种);
⑶B通常以六元环状结构存在,写出B的环状结构简式: 。
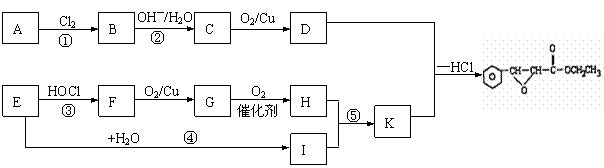
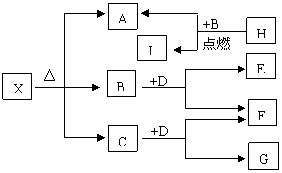
22、(10分)已知X是一种盐,H是常见金属单质,
F、I是常见的非金属单质,E、G都是工业上
重要的碱性物质,它们有右图所示的关系,
试回答下列问题:
⑴G的化学式为
⑵写出下列反应的化学方程式
①
②
⑶X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3:8,则X的化学式为: X与盐酸反应的化学方程式为: 。
21、(8分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)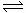 2NH3(g);△H=-92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g);△H=-92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
⑴合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A、采用较高压强(20Mpa~50Mpa)
B、采用500℃的高温
C、用铁触媒作催化剂
D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
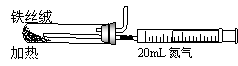 ⑵右图是实验室模拟工业法合成氨的简易装置。
⑵右图是实验室模拟工业法合成氨的简易装置。
简述检验有氨气生成的方法 。
⑶在298K时,将10molN2和30molH2放入合成塔中,
 为何放出的热量小于924kJ?
为何放出的热量小于924kJ?
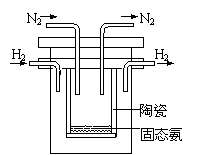
⑷1998年希腊亚里斯多德大学的Marnellos和Stoukides采用
高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高
转化率的电化学合成氨。其实验装置如图。
阴极的电极反应式 。
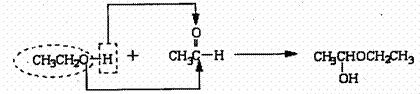
20、 (8分)溴乙烷是重要的化工原料,实验室制取溴乙烷(沸点38.4℃)的原理及步骤如下:
(8分)溴乙烷是重要的化工原料,实验室制取溴乙烷(沸点38.4℃)的原理及步骤如下:
⑴反应原理:C2H5OH+NaBr+H2SO4 NaHSO4+C2H5Br+H2O
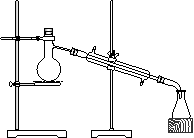 ⑵主要反应装置见下图
⑵主要反应装置见下图
⑶操作步骤:
① 在100mL圆底烧瓶中加入10mL95%乙醇、28mL78%硫酸,
然后加入研细的13g溴化钠。
② 加入几粒碎瓷片,小心摇动烧瓶使其均匀。将烧瓶与直形
冷凝管相连,冷凝管下端连接尾接管。
③ 小心加热,使其充分反应,再进行蒸馏,直到无溴乙烷
流出为止。
④再将锥形瓶中液体冷却后倒入亚硫酸钠溶液中洗涤分液。
试回答下列问题:
①本实验用的是78%的硫酸,为何不用浓硫酸?
②亚硫酸钠溶液的作用是
③该实验中会产生许多生成有机物的副反应,写出化学方程式:
(举一例)
④本次实验只收集到5mL溴乙烷,比理想产量约10mL少,原因是溴乙烷易挥发的缘故,为了减少其损失,你认为可采取什么措施?
19、(14分)试完成下列两小题:
⑴(4分)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)
A、氢气还原氧化铜实验中,先加热氧化铜后通氢气
B、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C、实验室做钠的实验时,余下的钠屑投入到废液缸中
D、配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E、皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F、制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
⑵(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-==I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-==S4O62-+3I-。
准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是
②实验中加入,你认为硫酸的作用是
③本实验中用碘量瓶而不用普通锥形瓶是因为:
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
18、将amol/L的Na2CO3溶液与bmol/L的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确的是
A、c(Na+)+ c(H+)>c(CO32-)+ c(HCO3-)+ c(OH-)
B、c(Na+)>c(CO32-)+ c(HCO3-) +c(H2CO3)
C、若c(Na+)> c(HCO3-) >c(CO32-)>c(OH-)>c(H+),则一定a<b
D、若c(CO32-)+2 c(OH-)==2c(H+)+ c(HCO3-)+3 c(H2CO3),则可确定a=b
第Ⅱ卷(非选择题 共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com