
题目列表(包括答案和解析)
23、(11分)某溶液中可能含有C032-、S042-、 HCO3-三种离子中的一种或两种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,在小明实验的基础上做进一步的实验,对小明的实验给出结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸、;lmol/L氯化钡、澄清石灰水、蒸馏水。
完成下列探究过程:
(l)提出假设:
假设 l :溶液中只存在C032- 假设 2 :
假设 3 : 假设 4 :溶液中存在S042-、 HCO3-
(2) 基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
[提示]I、在答题卡上按照下表的方式作答,注意前后内容的对应。
Ⅱ、注意文字简洁,超出答题卡空间视为无效。
III 、可不填满,也可增加步骤。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
22、(10分)某实验小组在进行双氧水分解的实验时发现:大家取相同体积、不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究。
(l)用下列简图,在答题卡的方框中画出实验装置(含试剂)示意图。( 3 分)

(2)小组经过实验,取得如下数据: ( 7 分)

(说明:表中X是二氧化锰的质量;Y是指反应停止时的时间;Z是双氧水的含量)
分析表中数据回答下列问题:
①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而 。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入 g的二氧化锰为较佳选择,理由是
③该小组的小茂同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确 ,理由是
21、(10分)侯氏制碱法原理是:将NH3和CO2气体通人饱和食盐水中即可获得NaHCO3和NH4Cl 的混合物,然后分离出 NaHCO3 再加热制得纯碱。其流程如下:
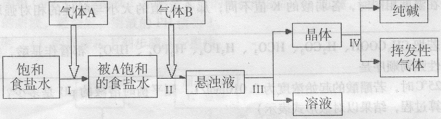
参照下表:
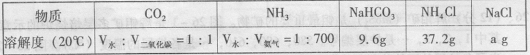
回答下列问题:
(l)气体A、B依次是:( )
A、CO2 ,NH3 B、NH3 ; CO2 C、任何顺序都可以
(2)写出(I)和(Ⅱ)步骤总的化学反应方程式:
由反应原理可知,a 9.6(填“ < ”、“ > ”或“ = " )
(3)操作(Ⅲ)的名称是: ,化学实验室进行该操作用到的玻璃仪器有: 。
(4)经步骤(Ⅲ)所得液体中含有的盐为(写化学式): 经过 (填操作名称)后可以得到化肥。
(5)每当通入NH3 44.8L(已折合成标准状况下)时可以得到纯碱100.0g,则NH3的利用率为
20、如右图所示a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1,一段时间(上为K2,下为K1) ,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
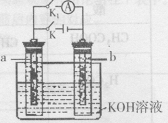 A、断开K2,闭合K1一段时间,溶液的pH要变大
A、断开K2,闭合K1一段时间,溶液的pH要变大
B、断开K1,闭合K2时,b 极上的电极反应式为:
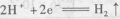
C、断开K2,闭合K1时,a 极上的电极反应式为:

D、断开K1,闭合K2时, OH一向b极移动
19、将甲和乙气体同时通入过量丙溶液中,可能产生沉淀的组合是
|
序号 |
|
|
|
|
① |
CO2 |
SO2 |
Ca(OH)2 |
|
② |
HCl |
CO2 |
Ca(OH)2 |
|
③ |
CO2 |
SO2 |
Ba(NO3)2 |
|
④ |
NO2 |
SO2 |
CaCl2 |
|
⑤ |
CO2 |
NH3 |
CaCl2 |
|
⑥ |
O2 |
NH3 |
AlCl3 |
18、下列溶液中各微粒的浓度关系正确的是
A、物质的量浓度相等的C(NH4)2 SO4、NH4HSO4、NH4Cl溶液中C(NH4+) : 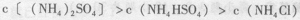
B、向醋酸钠溶液中加入适量酷酸,得到的酸性混合溶液: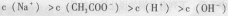
C 、某二元弱酸的酸式盐NaHA溶液中:
D、1.0mol/LNa2C03溶液:
17、世界上60%的镁是从海水中提取的,其主要步骤如下: ① 把贝壳制成石灰乳; ② 在海水中加人石灰乳,过滤,洗涤沉淀物; ③ 将沉淀物与盐酸反应,结晶、过滤; ④ 在氯化氢热气流中干燥晶体; ⑤ 电解上述晶体的熔融物。下列说法正确的是
A、镁元素在元素周期表中位于第三周期、ⅡA 族
B、向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C、在氯化氢热气流中干燥晶体的目的是加快干燥速度
D、步骤 ⑤ 也可以采用电解该晶体水溶液的方法
16、在指定环境中,下列各组离子可以大量共存的是
A、在中性溶液中:Al3+、K+、S042-、 HCO3-
B、在0.1mol/L的氯化铁溶液中:Fe3+、NH4+、NO3-、Cl-
C、在PH =11的溶液中:S2一、S032-、K+、Na+、C032-
D、在酸性溶液中: AlO2-、K+、I一、NO3-、Na+
15、将总物质的量为n mol的钠和铝(其中钠的物质的量分数为x ) ,投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL 。下列关系式中正确的是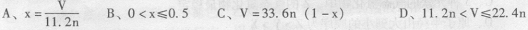
14、NA表示阿伏加德罗常数,下列叙述中正确的是
A、0.1mol Fe与0.lmol Cl2充分反应,转移的电子数为0.3NA
B、标准状况下,11.2LNO2和11.2LN2O4的混合,平衡时所含的分子数为l.5NA
C、2.0gD20中所含中子数为0.1NA
D、常温常压下, 229 氧气和 269 臭氧所含氧原子总数为 3N ^
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com