
题目列表(包括答案和解析)
4.由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为( )
A.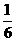 B.
B.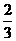 C.
C.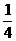 D.
D.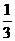
3.(2007年高考上海化学卷,物质的量)下列有关物理量相应的单位表达错误的是( )
A.摩尔质量g/mol B.气体摩尔体积L/mol C.溶解度g/100g D.密度g/cm3
2.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1.8g铵根离子所含的电子数为1.1NA B.1mol白磷分子中所含共价键数为4NA
C.标准状况下22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液pH为14,又知电解后溶液总体积为1L,
则阴极析出的气体的分子数为0.5NA
1.下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4 D.压强相同,体积相同的O2和H2
29、(10分)Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1) As 的价层电子构型为
(2) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体A12C16形式存在,其中铝原子与氯原子的成键类型是
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与个N原子相连,与同一个Al原子相连的N原子构成的空间构型为。在四大晶体类型中,AlN属于 晶体。
(4)Si和C 同主族,Si、C和0成键情况如下:
在C和0之间可以形成双键形成CO2分子,而Si和O则不能和碳那样形成有限分子原因是
(5)SiCl4(l)常用作烟雾剂,原因Si存在3d轨道,能同H20 (l)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理
28、(10分)奥美拉哇(OmePrazole)是基于2005年诺贝尔医学奖成果研制的药物,该药物对幽门螺旋杆菌引起的胃及十二指肠溃疡根治率最高。奥美拉哇的合成路线如下(Me表示甲基):
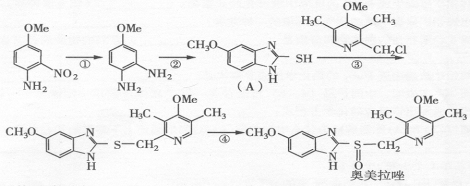
试回答下列问题: (l)奥美拉哇的分子式是:
(2)指出下列反应的类型: ① ; ③
(3)反应②是与一种无机小分子在氢氧化锂催化下发生的反应,二者各一分子反应在得到 A 的同时还得到一分子的硫化氢,则该无机小分子的化学式为: 。
(4)反应④是用液态氧化剂氧化而发生的反应,除生成奥美拉哇外还生成水,请写出④的化学反应方程式:
(5)根据结构判断奥美拉哇可能发生的化学反应是:
A、与氢氧化钠发生水解反应 B、能与氯气发生加成反应
C、与乙酸发生酯化反应 D、能使酸性高锰酸钾溶液褪色
27、(9分)萨罗(Salol)是一种消毒剂,它的分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键) : (l)根据上图模型写出萨罗的结构简式: 。 (2)写出萨罗分子结构中含有官能团的名称: 。
(3)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸。请写出其水解方程式:
(4)写出同时符合下列四种条件的水杨酸的同分异构体共有 种。 ①含有苯环; ②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1 mol该同分异构体能与2mol NaOH发生反应;④只能生成两种一氯代产物。
(5)从(4)确定的同分异构体中任选一种,指定为下列框图中的A。
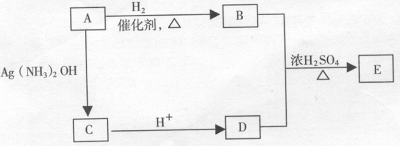
写出下列反应的化学方程式:
B + D→E : 该反应属于 反应。六、选做题(本题包括2小题,每题10分,考生只能选做一题,28 小题为“物质结构与性质”内容的试题 ,29 题为“有机化学基础”内容的试题)。
26、(12分)辉钼矿(MoS2)是钼最重要的矿物。图26一l是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,… 是各炉层的温度(℃)。图26一2给出了各炉层的固体物料的摩尔百分组成。已知:MoS2焙烧生成1molMoO3的反应热为 △H1=一1011 KJ/mol, MoO2氧化生成lmolMoO3的反应热为△H2=一154KJ/mol。试回答:
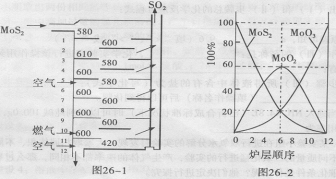
(l)辉铝矿焙烧生成MoO3的反应中被氧化的元素是: (填元素符号);指出辉钼矿焙烧生成的尾气对环境的一种危害:
(2)第6炉层存在的固体物质分别是: 它们的物质的量之比是:
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是:
(4)图26一2表明,中间炉层(4一6)可能存在一种“固体+固体、固体+ … ”的反应,请写出该反应的化学方程式:
(5)通过(3)和(4)你能解释为什么中间炉层(4一6)的炉温比上下炉层的炉温低吗?
25、(8分)与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用 K 表示, K 只与温度有关)。下表是几种常见弱酸的电离平衡常数(25℃)。

回答下列各题: (l)温度升高时, (填“促进”或“抑制”)弱酸的电离, K 值 (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是
。
(3)若把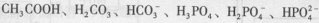 都看作是酸,则它们酸性强弱顺序是
。
都看作是酸,则它们酸性强弱顺序是
。
(4) 25℃时,若醋酸的起始浓度为0.0l0mol/L ,则平衡时溶液的pH是多少?(写出计算过程,结果以对数形式表示)
24、(10分)制取纯净CuCl2·2H20的生产过程是: (l)用粗CuO(含少量铁)溶解在足量的稀盐酸里加热、过滤,得到Cu Cl2(含FeCl2)的溶液,经测定,溶液的PH值为3 。 (2)对(l)的溶液按下列步骤进行提纯: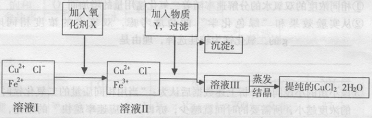
已知:①可做氧化剂的物质有(A) KMnO4(B) K2Cr2O7 (C) H2O2 (D)NaClO
②Cu2+、Fe2十在PH值为4一5时不水解,而Fe3+却几乎全部水解。试回答:
(l)加入的氧化剂x是(答编号): ; 加入x 的作用是: ; 反应的离子方程式是:
(2)物质 Y 是 ;沉淀z是 。加入Y 能形成沉淀z的原因是
(3)分离出沉淀z,并将溶液班蒸发欲获得晶体CuCl2·2H20。采取什么措施才能顺利得到晶体CuCl2·2H20?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com