
题目列表(包括答案和解析)
25.(10分)将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
Ⅰ、取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
Ⅱ、另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
Ⅲ、再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,到一种无色气体,其体积换算成 标准状况时为0.448 L ;
请根据以上实验中得到的数据分析计算:
⑴ 原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
⑵ 所得混合溶液中c(Cu2+)的取值范围;
⑶ 若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
24.(8分)治理硝酸工业中的尾气中的氮氧化物(NO、NO2)的化学原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O。
现有标准状况下的a LNO2(其中N2O4的体积分数为20%)、b LNO的混合气体,恰好被200mL一定浓度的NaOH溶液完全吸收。
⑴根据上述条件可知,a∶b的值应在 范围中;
⑵设生成的NaNO3的物质的量为n1,NaNO2的物质的量为n2
①当产物全部为NaNO2时,求n2的值;
②当产物中兼有NaNO3和NaNO2时,求n1和n2的值;
③求上述NaOH溶液的物质的量浓度。
23.钨是我国丰产元素 , 是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。 白钨矿的主要成分是钨酸钙 (CaW04); 黑钨矿的主要成分是铁和锰的钨酸盐 , 化学式常写成(Fe,Mn)W04。黑钨矿传统冶炼工艺的第一阶段是碱熔法 :

其中 A 、 B 、 C 都是钨的化合物。
(1) 写出上述流程中 A 、 B 、 c 的化学式。
A_________________ B_________________ C__________________
(2) 钨冶炼工艺的第二二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时 , 可用碳作还原剂。当有12mol电子转移时,该反应要吸收QkJ的热量(Q>0),写出用碳还原氧化钨制取金属钨的的热化学方程_______________________
(3)仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了监色的、非整比的钨氧化物 WO3-x。 这种监色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985。
①计算 W03-x中的x值。X=__________________
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这两种价态的钨原子数比。___________:___________
( 相对原子质量 : W: 183.84 0: 16.00)
22.(10分)烯烃被酸性KMnO4氧化的产物与不饱和碳原子上的氢原子数有关,如:
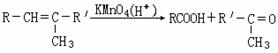
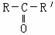
 具有结构的有机物称之为酮,能发生如下反应:
具有结构的有机物称之为酮,能发生如下反应:
从有机物A出发,经过一系列反应可以合成天然橡胶F:(反应条件未注明)
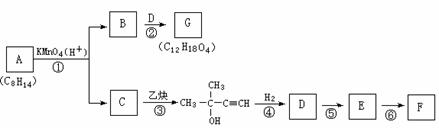
A分子中所有C原子有可能都在同一平面上,其一氯取代物只有两种同分异构体;天然橡
 胶F的结构为:
胶F的结构为:
请按要求填空:
⑴A的结构简式是 ,C的结构简式是 ;
⑵指出下列反应的类型:反应③ ,反应⑤ ;
⑶写出下列反应的化学方程式:
反应② ,
反应⑥ 。
21.(8分)含有两个碳碳双键的碳氢化合物称为二烯烃,1,3-丁二烯(CH2=CH-CH=CH2)是最典型的二烯烃。1,3-丁二烯与HCl按物质的量1∶1加成时有两种产物:

⑴上述1,2-加成产物的名称是 ;
⑵ 在光和热的作用下,两分子的1,3丁二烯可以发生自身的1,2-及1,4-加成作用生成环状二烯烃。如在100℃以上主要生成含一个六元环的二烯烃,其结构简式是 ;
⑶“⑵”中的产物有多种同分异构体,请按要求写出其中的两种:
① 具有八元环且分子结构对称的环状二烯烃 ;
② 具有环丁烷结构且有两个支链的二烯烃 ;
⑷ 1,3-丁二烯在乙酰丙酮镍的催化作用下发生三聚作用,生成一种无支链的环状三烯烃,请你写出该环状三烯烃的结构简式 。
20.(10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。

请按要求回答:
⑴写出C的电子式 ,I的化学式 ;
⑵反应③的化学方程式为 ;
⑶反应④的离子方程式为 ;
⑷由C制取E时反应物的状态是 。
19.(9分)化学课外小组在查阅资料时发现一个故事:古代道士炼丹时得到了一种红色的丹砂,被他们认为是长生不老的灵丹妙药,曾献给皇上服用,结果……
他们在资料上又得到了丹砂是由两种元素组成的化合物。为探究丹砂的成分,他们称取ag丹砂并设计出了下列实验方案:
请回答下列问题:
(1)a= ;丹砂的化学式是 。
(2)指出丹砂中原子序数较小的元素所在周期表中的位置: 。
(3)步骤X是一组系列操作,它们是: 。
(4)写出离子反应方程式:
A→C: ;B→E: 。
(5)另外一组化学课外活动小组也分析并试做了他们设计的实验,但小青试做时得到的D的质量小于2.33g,请你帮助分析小青可能存在的问题(至少两个)
① ;② 。

2. 。
实验原理:(提示:结合题中信息和实验目的进行分析) 。
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写) 。
实验步骤:(用准确、简洁的语言填写下表)
|
实 验 步 骤 |
实验现象 |
化 学 方 程 式 或 实 验 结 论 |
|
|
固体在水中 溶 解 |
|
|
|
溶液出现棕 黄 色 |
2IO3-+5HSO3-=3H++5SO42-+H2O+I2 |
|
|
|
“淮”牌精制盐中含有碘元素。 |
问题讨论:徐州虽远离大海,但现代的交通很是发达,因此徐州的海带等海产品也很丰富,海产品中或多或少的含有碘元素,且徐州人也很爱吃海产品,那徐州人的食用盐中需要加碘吗?说明你的理由。
18.(11分)I、下表是徐州某超市出售的“淮牌”加碘精制盐的有关说明:
|
产 品 标 准 号 |
Q/320000JYJ03-2004 |
|
许 可 证 号 |
食盐批字第100070号 |
|
配 料 表 |
精制盐、碘酸钾 |
|
含 碘 量 |
35±15mg/kg |
|
卫生许可证号 |
东卫食字(2005)第00015号 |
|
分 装 日 期 |
见封口 |
|
储 藏 方 法 |
通风、防潮 |
|
食 用 方 法 |
根据烹调所需适量加入 |
|
食品标签认可号 |
苏食签(2002)007号 |
II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。目前世界上碘主要来自智利硝石,其中含碘0.02%-1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2 …………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………⑵
反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应。
根据以上信息,回答下列问题:
⑴反应⑴、反应⑵的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3=H++HSO3-)
反应⑴: ;反应⑵: ;
⑵请你设计实验探究上述 “淮牌”精制盐中是否真的含有碘元素。
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
17.(11分)请按要求填空
I、 下列实验操作或对实验事实的描述不正确的是 (填序号)
① 将乙烯、乙炔分别通入溴水中,乙炔使溴水的褪色速度快
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
 II、(7分)已知:KMnO4、MnO2在酸性条件下均能将草酸钠氧化,Mn元素均被还原为Mn2+。某研究小组为测定软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品置于一烧杯中,加入2.68g草酸钠固体,再加入过量的稀硫酸并加热(杂质不参加反应并且不溶于酸),充分反应后冷却、滤去杂质,将所得溶液全部转移到100mL容量瓶中并定容后备用;准确量取20.00mL 0.0400mol·L-1的KMnO4标准溶液置于锥形瓶中,再从容量瓶中取出部分溶液置于一洁净且不漏水的滴定管中进行滴定,当滴入25.00mL待测液时恰好完全反应。请回答下列问题:
II、(7分)已知:KMnO4、MnO2在酸性条件下均能将草酸钠氧化,Mn元素均被还原为Mn2+。某研究小组为测定软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品置于一烧杯中,加入2.68g草酸钠固体,再加入过量的稀硫酸并加热(杂质不参加反应并且不溶于酸),充分反应后冷却、滤去杂质,将所得溶液全部转移到100mL容量瓶中并定容后备用;准确量取20.00mL 0.0400mol·L-1的KMnO4标准溶液置于锥形瓶中,再从容量瓶中取出部分溶液置于一洁净且不漏水的滴定管中进行滴定,当滴入25.00mL待测液时恰好完全反应。请回答下列问题:
① 写出MnO2氧化草酸钠的离子方程式 ;
② 将MnO2氧化草酸钠后的溶液全部转移到100mL容量瓶中的具体操作是 ;
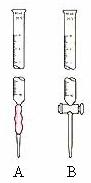
③ 从容量瓶中取出的部分溶液应置于 (选填“A”或“B”)滴定管中;滴定前必须进行的操作是
④ 你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”),若回答“能”,请求出计算结果;若回答“否”,请说明原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com