
题目列表(包括答案和解析)
7.下面几位同学自己总结出的结论中不正确的是
A.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
B.式量比空气(29)小的气体不可以使用向上排空气法收集
C.有些化学反应可以不属于化合、分解、置换、复分解中的任何一种反应类型
D.原子晶体的熔点不一定都比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
1.在2008年春节期间,许多遭受雪灾的地区使用融雪盐除雪。下列有关说法不正确的是
A.融雪盐能使盐水混合物的凝固点降低
B.融雪盐只能使用氯化钠
C.过量使用融雪盐会加速钢铁桥梁的腐蚀
D.撒了融雪盐的积雪不宜往绿地、河流中倾倒
15.质量分数不等的两种硫酸钠溶液等质量混合时,其质量分数为a %,而等体积混合后的质量分数为b %;质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a %,,而等体积混合后的质量分数为c %。则a、b、c的大小关系正确的是:
A.a>b>c B. b>a>c C. c>a>b D. c>a>b
14.某盐酸的浓度为12.0 mol·L-1,其密度为1.19 g·cm-3。现有该浓度的盐酸100 m3,则用于吸收HCl形成该盐酸的水的体积是:
A.75.2 m3 B.85.5 m3 C.90.8 m3 D.100 m3
13.体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2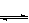 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率:
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率:
A、等于p% B、大于p% C、小于p% D、无法判断
12. 酸式盐NaHB在水溶液中,HB–的电离程度小于HB–的水解程度,下列说法不正确的是:
 A.HB–水解方程式:HB–+H2O H3O++B2–
A.HB–水解方程式:HB–+H2O H3O++B2–
B.溶液中离子浓度大小为:c (Na+)>c(HB–)>c(OH–)>c(H+)
C.NaHB的促进了水的电离
D.相同物质的量浓度溶液的pH值:Na2B>NaHB
11. 用NA表示阿伏加德罗常数,则下列说法错误的是:
A.1 molCH5+所含的电子数为10NA B.1 molC20H42中含有61 NA个共价键
C.25℃时1 mL纯水中含10–10NA个OH–离子 D.22.4 L的NH3中含有4 NA个原子
10.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a Y(g)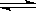 b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
A、a=1,b=1 B、a=2,b=1 C、a=2,b=2 D、a=3,b=4
9.下列比较不正确的是:
A.熔沸点高低:HF<HCl<HBr<HI
B.离子半径大小:AL3+ <Mg2+<<F-< Cl-
C.分散质微粒直径大小:Fe(OH)3胶体>NaCl溶液
D.酸性强弱:H2SO3>CH3COOH>H2CO3>H2SiO3
8. 某种氯化镁晶体有24Mg2+、35Cl–、37Cl–、三种离子组成,在熔融状态下,使1mol这种氯化镁完全电解,测得产生的气体质量为同体积氧气质量的2.22倍。则这种氯化镁晶体中35Cl–与37Cl–与的物质的量之比为:
A.1:2 B.2:3 C.1:3 D.3:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com