
题目列表(包括答案和解析)
15、(2007福建卷)(15分)W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X与Y不在同一周期,它们能形成XY2的化合物。
请回答:
⑴W元素是 ;Z元素是 。
⑵WY和WX2的化学式分别是 和 。
⑶Y和Z形成的两种常见化合物的分子式是 、 。
⑷写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:
。
14.(2007天津卷)(14分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明____________________________________________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
13. (2007年全国II)(15分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:
⑴A元素是 ① 、B元素是 ② 、C元素是 ③ (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 ④ 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 ⑤ 。
⑷F是由两种元素组成的三原子分子,其分子式是 ⑥ ,电子式是 ⑦ 。
⑸G分子中含有4个原子,其分子式是 ⑧ 。
⑹H分子中含有8个原子,其分子式是 ⑨ 。
12. (8分)(2007山东卷)[化学-物质结构与性质]
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测
NCl3水解的主要产物是 (填化学式)。
11.(2008年山东)[化学-物质结构与性质]氮是地球上极为丰富的元素。
⑴Li3N晶体中氮以N3-的存在,基态N3-的电子排布式为 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
 ⑶(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
(填“大”或“小”),可用作
(填代号)
⑶(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
(填“大”或“小”),可用作
(填代号)
a.助燃剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
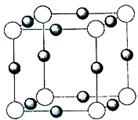
⑷X+中所有电子正好充满KLM三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
10.(2006年上海卷)(B)下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
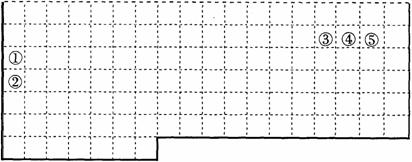
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个。
元素③氢化物的电子式为_______。
(3)元素④-般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
A 元素①的单质 B 元素②的单质
C 元素①②形成的合金 D 无法判断
10.(2006年上海卷)(A)
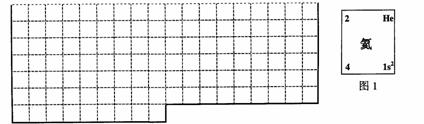
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
 (2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________
甲、乙的最高价氧化物水化物的酸性强弱为:________>________(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系: __________________________________________________________________________
9. (2006年全国)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是 ;
(2)Y是 ,Z是 ,W是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式 。
8、(2006年北京卷)(14分)有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:⑴Y的最高价氧化物对应水化物的化学式是 。
⑵将ZY3溶液滴入沸水可得红褐色液体,反应的离子方程式是
,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
⑶X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol 该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为 。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是
。
7、(B)
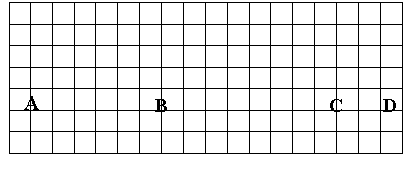 (1)在上面元素周期表中全部是金属元素的区域为
(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B
(c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com