
题目列表(包括答案和解析)
1.NA为阿佛加德罗常数,下述正确的是 ( )
A.80g硝酸铵含有氮原子数为2NA
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1mol铜失去的电子数为2 NA
27.(08山东卷)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
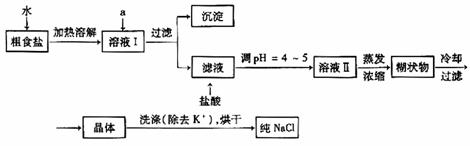
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
 ②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用
仪器除药匙、玻璃棒外还有________(填仪器名称)。
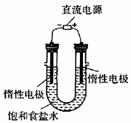
(3) 电解饱和食盐水的装置如图所示,若收集的H2为2 L,
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是
__________。装置改进后,可用于制备NaOH溶液,若测定溶液中
NaOH的浓度,常用的方法是_____________。
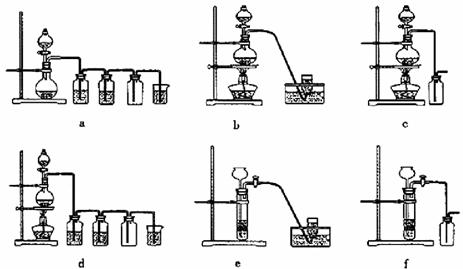
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
解析:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-。Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+。②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中。
(3)2NaCl+2H2O 2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。
2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。
答案:(1)①BaCl2、NaOH、Na2CO3。②75%乙醇。
(2)天平、烧杯、500 mL容量瓶、胶头滴管。
(3)<;电解生成的氯气与电解生成的NaOH发生了反应;中和滴定。
(4)e;d。
26.(北京卷28).(14分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_______________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是______。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是__________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)__________。
答案: (1)Al
(2)① C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
② NO CO2
(3)Cu2+ Fe3+ H+
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(5)CuO、C; CuO、C、Fe2O3
点拨:无机推断题为主体的综合题,主要考查金属单质、金属氧化物、非金属单质的性质。本题综合性强,涉及知识面广,难度较大。
解决问题的基本出发点是:能与Fe2O3、Fe、CuO、C、Al物质反应产生两种气体的浓酸不可能是浓盐酸;如果是浓硫酸,可以与Fe、C、Al单质发生氧化还原反应,浓硫酸被还原为SO2,C被氧化为CO2, Fe和Al被氧化为Fe3+和Al3+,如果是浓硝酸,则两种气体是SO2和NO2,其变化与加浓硫酸的反应相同。无论是那种浓酸均可以使两种氧化物Fe2O3、CuO转化为对应的盐。
⑴ 无论加什么浓酸(硫酸和硝酸),溶液X中都可能含有Fe3+、Cu2+、Al3+三种金属阳离子。向溶液X中加入过量的NaOH溶液,可转化为Fe(OH)3和COH)2沉淀析出,如果有Al3+,则可转化为ALO2-离子, 如果上层清液,通入CO2后,会发生反应,产生白色沉淀Al(OH)3,
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 与题目中“取上层清液,通入CO2,无明显变化,”不相符,所以,可以肯定溶液X中没有AlO2-,样品中没有Al。
⑵ 有了前面的分析,设问⑵就比较容易解决了(分析略);
⑶ 向溶液X中加过量Fe粉,得Y溶液和两种固体,且一种固体为红色(Cu),另一种就是过量的Fe粉,这个过程发生了置换反应:Cu2++Fe = Cu+Fe2+,
向Y溶液中通入过量氯气,并不断搅拌,会发生如下反应:
Cl2+2Fe2+=2Cl-+2Fe3+ 2Fe3++Cu=2Fe2++Cu2+ Cl2+H2O?HCl+HClO ,
充分反应后,溶液中的阳离子是:Cu2+、Fe3+ 、H+(特别注意没有了Fe2+)。
⑷ 取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,定量计算方程式的书写,依据信息“当消耗2 mol I-时,共转移3 mol电子”参加反应的还原剂的量比:转移3 mol电子其中2 mol 来自I-,令外1 mol电子来自Fe2+,这样才能写书方程式:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
⑸ 设问⑸的目的是推测样品可能的组合,根据前面四步设问知道,样品中一定没有Al,一定有CuO和C,不能确定是否有Fe和Fe2O3 ,加入足量稀硫酸后一定不产生Cu ,那么排除Fe , 符合整个设问的组合只有两种为:CuO、C ;CuO、C、Fe2O3 。
25.(江苏卷17).(10分)工业上制备BaCl2的工艺流程图如下:
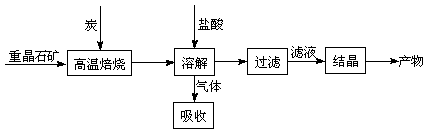
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,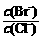 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
解析:⑴S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
⑵2.7×10-3 ⑶172.5
⑷使BaSO4得到充分的还原(或提高BaS的产量)
①②为吸热反应,炭和氧气反应放热维持反应所需高温
24.(江苏卷15).金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子M(CN)nm-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
 Ag++2CN - == [Ag(CN)2]
-
Ag++2CN - == [Ag(CN)2]
-
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
⑴水样预处理的目的是 。
⑵水样预处理的装置如右图,细导管插入吸收液中是为了
。
⑶蒸馏瓶比吸收液面要高出很多,其目的是 。
⑷如果用盐酸代替磷酸进行预处理,实验结果将 (填“偏高”、“无影响”或“偏低”)。
⑸准确移取某工厂污水100mL,经处理后用浓度为0.01000mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg·L-1的(以计,计算结果保留一位小数)。
解析:⑴将含氰化合物全部转化为CN - ⑵完全吸收HCN,防止气体放空
⑶防止倒吸 ⑷偏高 ⑸109.2
23.(海南卷16).现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2
 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2 +6H2O
MgO+H2↑ ⑤Mg3N2 +6H2O  3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
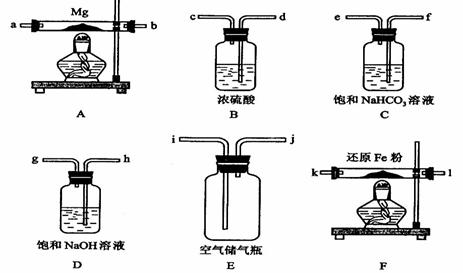
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___________________ _;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是____________________;
(4)请设计一个实验,验证产物是氮化镁:
______________________________________________________________________
解析:16、(1)B、D、F
选择B,目的:除去空气中的水蒸气
选择D,目的:除去空气中的CO2
选择F,目的:除去空气中的O2
(2)h→g→d→c→k→l→a→b
(3)制得的氮化镁将不纯;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应。
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
22.(天津卷29)、(14分)(1)配平氧化还原反应方程式:□C2O42-+□MnO4-+□H+=□CO2+□Mn2++□H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
③原试样中H2C2O4·2H2O的质量分数为 。KHC2O4的质量分数为 。
[解析](1)标出化合价升降:C2O42- CO2,MnO4-
CO2,MnO4- Mn2+;根据化合价变化,求2和5的最小公倍数:
Mn2+;根据化合价变化,求2和5的最小公倍数: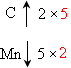 ,可知在C2O42-前加系数5,在MnO4-前加系数2,然后根据电荷守恒和原子守恒,利用观察法,可得配平方程式:5C2O42-+2MnO4-+16H+=1OCO2↑+2Mn2++8H2O。
,可知在C2O42-前加系数5,在MnO4-前加系数2,然后根据电荷守恒和原子守恒,利用观察法,可得配平方程式:5C2O42-+2MnO4-+16H+=1OCO2↑+2Mn2++8H2O。
(2)①加NaOH变为浅红色,说明溶液呈弱碱性,则溶液中被中和的n(H+)=n(OH-)=0.25mol·L-1×0.02L=0.005mol。
②加入酸性KMnO4将C2O42-氧化,恰好反应时,溶液由无色变成紫红色;根据方程式可得关系式:5C2O42- 2MnO4-,n(C2O42-)=×n(KMnO4)=×0.1mol·L-1×0.016L=0.004mol。
2MnO4-,n(C2O42-)=×n(KMnO4)=×0.1mol·L-1×0.016L=0.004mol。
③因为和NaOH反应时,H+来源于H2C2O4·2H2O和KHC2O4,而和KMnO4反应时,C2O42-也来源于二者。设试样中含H2C2O4·2H2O、KHC2O4的物质的量分别为x、y,根据题意得:
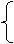 x+y=0.04
x+y=0.04
2x+y=0. 05
解之得:x=0.01mol,y=0.03mol。故m(H2C2O4·2H2O)=126g·mol-1×0.01mol=1.26g,则试样中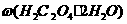 =×100%=21%;m(KHC2O4)=
128g·mol-1×0.03mol=3.84g,故
=×100%=21%;m(KHC2O4)=
128g·mol-1×0.03mol=3.84g,故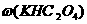 =×100%=64%。
=×100%=64%。
[答案](1)5 2 16 10 2 8 (2)①0.005 ②无色 紫红色 0.004 ③21% 64%。
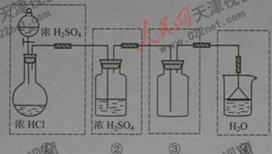
21.(天津卷28)、(19分)Ⅰ,(8分)化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢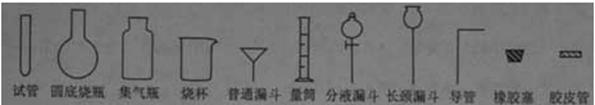 气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)
气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)
Ⅱ,(11分)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式: 。
(2)硫酸溶液过稀会导致 。
(3)采用水浴加热的原因是 。
(4)反应时铁屑过量的目的是(用离子方程式表示) 。
(5)溶液趁热过滤的原因是 。
塞紧试管口的目的是 。
(6)静置冷却一段时间后,在试管中观察到的现象是 。
I[解析]浓硫酸和浓盐酸反应制取HCl气体,不需要加热,即:液+液 气,可采用分液漏斗和圆底烧瓶组成发生装置;干燥HCl可以装有浓硫酸的洗瓶,收集HCl用向上排空气法,由于HCl气体极易溶于水,故在水面用倒扣的漏斗来吸收尾气。整个装置为:
气,可采用分液漏斗和圆底烧瓶组成发生装置;干燥HCl可以装有浓硫酸的洗瓶,收集HCl用向上排空气法,由于HCl气体极易溶于水,故在水面用倒扣的漏斗来吸收尾气。整个装置为:
Ⅱ[解析]⑴铁和稀硫酸反应的方程式为:Fe+H2SO4(稀)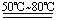 FeSO4+H2↑。
FeSO4+H2↑。
(2)硫酸如果浓度过稀,则反应时速率过慢;另外由于溶液中含有较多的水,也不利于硫酸亚铁晶体的析出。
(3)水浴加热受热均匀,温度容易控制。
(4)铁屑过量的目的是防止Fe2+被氧化成Fe3+,即使被氧化Fe可以使Fe3+还原:Fe+2Fe3+=3Fe2+。
(5)溶液趁热过滤的目的是减少FeSO4的损失;塞紧试管口的目的是防止空气中的氧气将FeSO4氧化。
(6)硫酸亚铁热溶液在冷却过程中,溶解度降低,在静止冷却一段时间后会有浅绿色硫酸亚铁晶体析出。
[答案]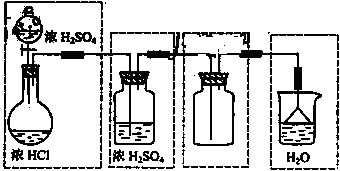
(1)Fe+H2SO4(稀) =FeSO4+H2↑
=FeSO4+H2↑
(2)反应速率慢 不利于晶体析出
(3)(4)Fe3++2Fe=3Fe2+
(5)减少FeSO4的损失
防止空气进入试管将Fe2+氧化为Fe3+
(6)有浅绿色晶体析出
20.(全国理综Ⅱ卷28).(13分)
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
答案:(1)①说明可能含有CO32-或者含有SO32- 因为二者水解均显碱性;
②肯定含有CO32- ,肯定不含SO32-、因SO2有刺激性气味
③肯定不含有Br-、I-,因两者均能与氯水反应后生成单质溴和单质碘,溴和碘单质溶解于CCl4显色;
④肯定含有SO42-,因BaSO4不溶于盐酸。
⑤肯定含有Cl-,因AgNO3与Cl-反应生成的AgCl不溶于稀HNO3。
(2)NO3-
考点:离子反应,实验问题
19.(宁夏卷27).(15分)
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将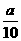 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1
的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
解析:(15分)
(1)2 10 8 5 2 1 8
(2)碱 KmnO4是强氧化剂,它会腐蚀乳胶管
(3)

(4)
①不一定准确 如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确
②不一定准确 如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确
注:本小题属于开放性试题,若考生回答“准确”或“不准确”且理由合理,可酌性给分。例如:考生回答
方案一准确,因为铁片中不存在能与稀硫酸反应并能生成氢气的其他金属,也不存在铁的氧化物
方案一不准确,如果铁片中存在与稀硫酸反应生成氢气的其他金属,会导致结果偏高;如果存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低
方案二准确,铁片溶于稀硫酸后,除Fe2+外,其他可能存在的金属离子在酸性溶液中均不能被高锰酸钾氧化,也不存在氧化铁
方案二不准确,如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果存在与稀硫酸反应而溶解的铁的氧化物,千百万的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com