
题目列表(包括答案和解析)
8.(08江苏卷)下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH-)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa);选项C中根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于c(CH3COOH)=c(CH3COONa),且它们等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,将①×2-②得:c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH);选项D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(A2-)>c(H+)>c(H2A)。
答案:A、C。
3.HCl与HAc均反应完后,继续滴加NH3·H2O弱电解质,电导率变化不大,因为溶液被稀释,有下降趋势。
综上所述:答案选D。
答案:D
2.当HCl被中和完后,继续与HAc弱电解质反应,生成NH4Ac的强电解质,所以电导率增大。
7.(08广东卷)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率
变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶
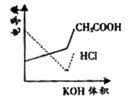 液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表 示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表 示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
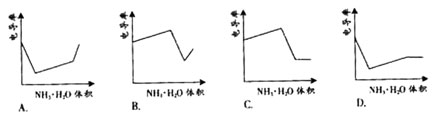
解析:1.HCl为强电解质,HAc为弱电解质,滴加NH3·H2O弱电解质先与HCl反应,生成同样为强电解质的NH4Cl,但溶液体积不断增大,溶液稀释,所以电导率下降。
6.(08广东卷)盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO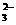 和OH-
和OH-
B.NaHCO3溶液中:e(H+)+e(H2CO3)=c(OH-)
C.10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
解析:A中,生成Na2CO3溶液,CO32-会发生水解,生成HCO3-,所以A错;
电荷守恒 :C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-)
物料守恒:C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3)
两式相减得 :C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 所以B错误。
C中,生成NaAc,Ac-水解呈碱性,故C正确;相同PH,相同体积的HCl和HAc,因为HAc为弱酸,所以HAc的物质的量浓度大,HAc所消耗的NaOH的物质的量多,D错。
答案:C
5.(08广东卷)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100
mL水中至刚好饱和,该过程中Ag+和SO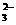 浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4
溶液,下列示意图中,能正确表示t1时刻后Ag+和SO
浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4
溶液,下列示意图中,能正确表示t1时刻后Ag+和SO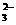 浓度随时间变化关系的是(
)
浓度随时间变化关系的是(
)
解析:Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol/L,所以c(SO42-)=0.017mol/L;当加入100ml 0.020mol/LNa2SO4溶液后,c(SO42-)=0.0185mol/L,c(Ag+)=0.017mol/L(此时Q<Ksp)。由计算可知选B。
答案:B
4.(08全国Ⅰ卷)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
解析:根据“越弱越水解”的原则,NaA的水解比HB水解程度大,所以溶液中的c(HA)>c(HB),c(A-)<c(B-);再根据“谁强显谁性”可知溶液中的c(OH-)>c(H+);由于溶液中离子的水解毕竟是微弱的,所以c(OH-)<c(A-)和c(B-)。
答案:A。
3.(08上海卷)某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
解析:此题的关键应注意题中的“酸性”两个字,选项B溶液NaOH与CH3COOH恰好完全反应,所以溶液呈碱性;选项C中当加入NaOH后溶液仍然呈酸性,则c(H+)>c(OH-),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C(CH3COO-),当碱过量时,必定c(Na+)>C(CH3COO-),所以在任何情况下溶液的离子关系都不能成立;选项D中加入氨水,由电荷守恒得:c(CH3COO-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(CH3COO-)>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c(CH3COO-)=c(NH4+)+c(Na+);当溶液呈碱性时,c(H+)<c(OH-),则c(CH3COO-)<c(NH4+)+c(Na+),所以c(CH3COO-)一不定大于c(Na+)、c(NH4+)之和。
答案:A
2.(08上海卷)常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
解析:某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,说明溶液既可能呈酸性,也有可能呈碱性。①SO2+H2O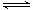 H2SO3,H2SO3
H2SO3,H2SO3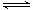 HSO3-+H+,HSO3-
HSO3-+H+,HSO3-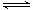 SO32-+H+,溶液呈酸性;④NaOH===Na++OH-,溶液呈碱性。
SO32-+H+,溶液呈酸性;④NaOH===Na++OH-,溶液呈碱性。
答案:A
1.(08海南卷)下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO- + H3O+
HCOO- + H3O+
B.CO2+H2O HCO3- + H+
HCO3- + H+
C.CO32- + H2O HCO3- + OH-
HCO3- + OH-
D.HS- + H2O S2- + H3O+
S2- + H3O+
解析:选项A、B、D表示的都是电离。
答案:C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com