
题目列表(包括答案和解析)
4、(2004年江苏卷)ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4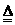 2ClO2↑+K2SO4+2CO2↑+2H2O
下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O
下列说法正确的是
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1 molKClO3参加反应有2mol电子转移
3.(2004上海卷)在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B. Cu C. Ag D. H2
2.(2004年北京春)已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+ Fe3++Ce3+ Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe3+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe3+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+ 、Sn2+ D.Fe3+、Sn2+、Ce3+
1.(2004年北京春)在下图所表示的微粒中,氧化性最强的是
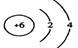
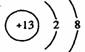
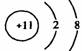
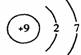
A. B. C. D.
39.(08海南卷)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
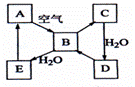
(1)写出A在加热条件下与H2反应的化学方程式
__________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式___________________________
(3)写出一个由D生成B的化学方程式____________________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
38. (2007年江苏(10分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是 ;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ;
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
37.(2008年海南)(8分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化
合物D是重要的工业原料。
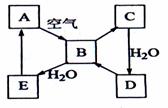
(1)写出A在加热条件下与H2反应的化学方程式___________________________________
(2)写出E与A的氢化物反应生成A的化学方程式___________________________
(3)写出一个由D生成B的化学方程式____________________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
36.(2007天津卷)(19分)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
① 将干燥的氯气在110℃ - 140℃与硫反应,即可得S2C12粗品。
② 有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
|
S |
112.8 |
444.6 |
略 |
|
S2C12 |
-77 |
137 |
遇水生成HCl、SO2、S; 300℃以上完全分解; S2C12 + C12 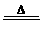 2SCl2 2SCl2 |
设计实验装置图如下:
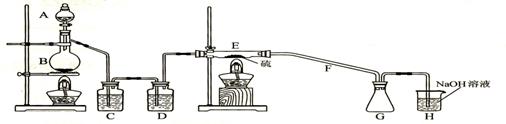
⑴.上图中气体发生和尾气处理装置不够完善,请你提出改进意见____________________________________________________________________________。
利用改进后的正确装置进行实验,请回答下列问题:
⑵.B中反应的离子方程式:_________________________________________________;
E中反应的化学方程式:_________________________________________________。
⑶.C、D中的试剂分别是__________________________、_______________________。
⑷.仪器A、B的名称分别是____________、____________,F的作用是___________。
⑸.如果在加热E时温度过高,对实验结果的影响是_____________________________,
在F中可能出现的现象是________________________________________________。
⑹.S2C12粗品中可能混有的杂质是(填写两种)______________、________________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________________。
35.(2006年上海卷)(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)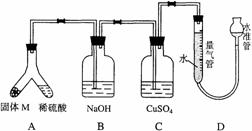
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式);理由是____________________________________________________________________。
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是_______。写出B装置中反应的离子方程式__________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_______________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
A M中有未反应的铁和硫 B 测定气体体积时水准管的水面高于量气管的水面
C A中留有反应生成的气体 D 气体进入D装置前未用浓硫酸干燥
34.(2005年广东)(14分)
研究性学习小组进行SO2的制备及性质探究实验。
⑴ 根据反应Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
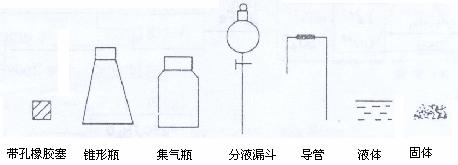
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是____________________________。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是__________________________________________________。
② 溴水溶液,现象是__________________________________________________。
③ 硫化钠溶液,现象是________________________________________________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因__________________________,验证方法______________________________。
② 原因__________________________,验证方法_______________________________。
③ 原因__________________________,验证方法________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com