
题目列表(包括答案和解析)
6、(1)P(s)+Cl2(g)===PCl3(g);△H=-306kJ·mol-1。
(2)PCl5(g)===PCl3(g)+Cl2(g);△H=93kJ·mol-1。25%;大于。
(3)两步反应均为放热反应,降低温度有利于提高产率,防止产物分解。
(4)-399kJ·mol-1;等于。
(5)PCl5+4H2O===H3PO4+5HCl。
5、CH4(g)+H2O(g)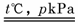 CO(g)+3H2 (g);△H=2a
kJ/mol
CO(g)+3H2 (g);△H=2a
kJ/mol
4、(1)P2O3 P2O5 2.75 3.55 (2)-(20X-Y)kJ/mol
(3)P(s)+O2(g)=P2O2(s); △H=-(20X-Y)kJ/mol
△H=-(20X-Y)kJ/mol
3、-80kJ·mol-1 防止高温下Mg(Ti)与空气中的O2(CO2、N2)作用
2、CH4(g)+2O2(g) CO2(g)+2H2O(1);△H=-891kJ/mol
6、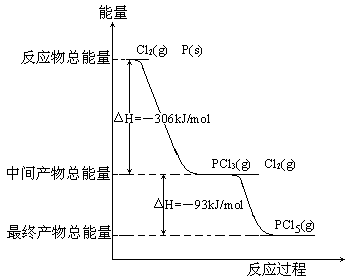 (08全国Ⅱ卷-27)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
(08全国Ⅱ卷-27)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是___________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________。
答案:1、H2(g)+1/2O2(g)=H2O(g):△H=-241.8kJ·mol-1 (4分)
-285.8 285.5 (4分)
5、(06四川卷29(1))已知0.5 mol甲烷与0.5 mol水蒸汽在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是: 。
4、[05天津卷29(14分)]磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
3、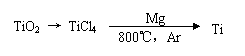 [05广东卷22(4)]由金红石(TiO2)制取单质Ti,涉及到的步骤为:
[05广东卷22(4)]由金红石(TiO2)制取单质Ti,涉及到的步骤为:
己知:①C (s) +O2 (g) = CO2 (g); △H = -393.5 kJ·mol-1
②2CO (g) + O2 (g) =2CO2 (g); △H = -566 kJ·mol-1
③TiO2(s) + 2Cl2 (g) =TiCl4(s) + O2(g);△H = +141 kJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s) + 2CO (g)的△H= _____ __________。
反应TiCl4 +2Mg=2MgCl2 +Ti在Ar气氛中进行的理由是___________________。
2、[05北京卷29(2)]已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com