
题目列表(包括答案和解析)
19. (2007年全国卷II-9)已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是( )
(A)氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g)
(B)氢气和氯气反应生成2 mol氯化氢气体,反应的DH = 183 kJ/mol
(C)氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol
(D)氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol
18.(2007年上海卷-14)已知:
CH3CH2CH2CH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2878 kJ
4CO2(g)+5H2O(l);DH =-2878 kJ
(CH3)2CHCH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);DH =-2869 kJ
4CO2(g)+5H2O(l);DH =-2869 kJ
下列说法正确的是( )
(A) 正丁烷分子储存的能量大于异丁烷分子
(B) 正丁烷的稳定性大于异丁烷
(C) 异丁烷转化为正丁烷的过程是一个放热过程
(D) 异丁烷分子中的碳氢键比正丁烷的多
17.(2007年江苏卷-7)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g);DH = + 49.0 kJ·mol-1
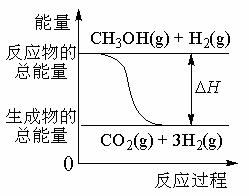 ②CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g);DH =-192.9 kJ·mol-1
②CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g);DH =-192.9 kJ·mol-1
下列说法正确的是( )
(A) CH3OH的燃烧热为192.9 kJ·mol-1
(B) 反应①中的能量变化如图所示
(C) CH3OH转变成H2的过程一定要吸收能量
(D) 根据②推知反应:
CH3OH(l)+1/2O2(g) = CO2(g)+2H2(g)的
DH>-192.9 kJ·mol-1
16.(2007年海南卷-6)已知:(1)Zn(s)+1/2O2(g) = ZnO(s);DH =-348.3 kJ/mol
(2)2Ag(s)+1/2O2(g) = Ag2O(s);DH =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的DH等于( )
(A)-317.3 kJ/mol (B)-379.3 kJ/mol(C)-332.8 kJ/mol (D)317.3 kJ/mol
15.(2007年高考广东化学卷-16)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);DH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);DH2
③Sn(s、灰)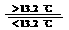 Sn(s、白);DH3=+2.1 kJ/mol
Sn(s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
(A) DH1>DH2 (B) 锡在常温下以灰锡状态存在
(C) 灰锡转化为白锡的反应是放热反应
(D) 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
14、(06天津13)已知反应:
①101KPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol下列结论正确的是( )
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3KJ热量
13、(06江苏卷8)下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
12、(06重庆卷10)25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是( )
A. C(s)+0.5O2(g)=CO(g);△H =-393.5 kJ/mol
B. 2H2(g)+O2(g)=2H2O(g);△H =+571.6 kJ/mol
C. CH4g)+2O2(g)=CO2(g)+2H2O(g);△H =-890.3 kJ/mol
D. 0.5C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H = -1400 kJ/mol
11、(05全国卷Ⅰ13)已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 ( )
A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+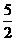 O2(g)
O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=b kJ/mol
10、(05江苏4)氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g) + 1/2O2(g) = H2O(l);△H= -285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= -283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= -5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= -890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com