
题目列表(包括答案和解析)
27.(08宁夏卷)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
答案:(1)S C
(2)V形;直线形;SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大。
(3)Cr;四;1s22s22p63s23p63d54s1;+6。
(4)F-H…F F-H…O O-H…F O-H…O。
26.(08四川卷)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是____________,写出该元素的任意3种含氧酸的化学式:_______________________。
(3)D和形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属_______________,其晶体类型属_____________________。
(5)金属镁和E的单质在高温下反应得到的产物是__________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低并说明理由_______________________________________。
解析:由已知条件可推知:D为C,E为N,X为Si,Y为S,Z为Cl。
答案:(1)SO3。
(2)Cl;HClO、HClO2、HClO3、HClO4。
(3)直线型。
(4)共价键;原子晶体。
(5)Mg3N2;Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑。
(6)D的最高价氧化物为CO2,X的最高价氧化物为SiO2,前者比后者的熔点低,因为前者为分子晶体,由分子间的作用力结合,而后者为原子晶体,由共价键结合,共价键之间的作用力远大于分子间的作用力。
25.(08北京卷)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核,通常状况下,W为无色液体,已知:X+Y Z+W。
Z+W。
(1)Y的电子式是_______________________。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a、向广口瓶内注入足量热NaOH溶液,将盛有Cu片的小烧杯放入瓶中。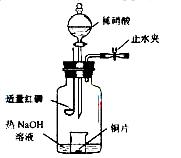
b、关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c、待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要实验操作是_______________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是_________________。
③步骤c滴入稀硝酸后烧杯中的现象是___________________________________。反应的离子方程式是________________________________________。
(4)一定温度下,将1molN2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色,温度继续由T1升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化如图所示。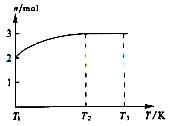
①温度在T1-T2之间,反应的化学方程式是___________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留一位小数) _______________________。
[解析]X、Y、Z、W含有相同电子数的分子或离子,其组成元素的序数均小于10,X有5个原子核,为CH4或NH4+,通常状况下,W为无色液体,为H2O;根据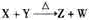 ,可知X为NH4+,Y为OH-,Z为NH3;故Y的电子式为:
,可知X为NH4+,Y为OH-,Z为NH3;故Y的电子式为: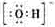 ,液氨电离和水相似,其电离式为:2NH3(l)=NH4++NH2-;用图示装置制备NO并验证其还原性,故整个操作中没有验证步骤,可以在制备到NO后,通入少量氧气,通过现象变化确定其还原性,故在c步骤中增加,打开止水夹,通入少量氧气;红磷充分燃烧生成P2O5,其余氢氧化钠反应为: P2O5+6OH-=2PO43-+3H2O,步骤c滴入硝酸后的现象为:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,反应为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O;1molN2O4置于密闭容器中,升温过程中,逐渐转变为红棕色,说明N2O4=2NO2,此时装置中为2molNO2,根据图像中表示的意义,继续加压时,气体的物质的量增多,且为无色,超T2温度后,物质的量约为3mol,故其反应式为:2NO2=O2+2NO,其相对分子质量为:30.7。
,液氨电离和水相似,其电离式为:2NH3(l)=NH4++NH2-;用图示装置制备NO并验证其还原性,故整个操作中没有验证步骤,可以在制备到NO后,通入少量氧气,通过现象变化确定其还原性,故在c步骤中增加,打开止水夹,通入少量氧气;红磷充分燃烧生成P2O5,其余氢氧化钠反应为: P2O5+6OH-=2PO43-+3H2O,步骤c滴入硝酸后的现象为:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,反应为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O;1molN2O4置于密闭容器中,升温过程中,逐渐转变为红棕色,说明N2O4=2NO2,此时装置中为2molNO2,根据图像中表示的意义,继续加压时,气体的物质的量增多,且为无色,超T2温度后,物质的量约为3mol,故其反应式为:2NO2=O2+2NO,其相对分子质量为:30.7。
[答案]

[高考考点]微粒结构、电子式书写、实验基本操作、离子方程式书写等知识
[易错提醒]不能正确理解题中给出的物质的物质的量的变化,错误的判断为二氧化氮和四氧化二氮的转化。
[备考提示]本题具有常见题的常规“题眼”,可运用“题眼”突破并进行解答。特别是其中对10电子、18电子微粒知识考查,我们在学习中要注意总结,并加以熟练运用。
24.(08天津卷)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为____________________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________。
(3)X的硝酸盐水溶 液显______性,用离子方程式解释原因___________________________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为____________________________。
(5)比较Y、Z气态氢化物的稳 定性_____>_______(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____>_____>______>______。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶 液,并放出QkJ的热量。写出该反应的热化学方程式:_______________________。
解析:因为这四种元素为同一短周期元素,W和X为金属元素,且各自的最高价氧化物对应的水化物可以反应生盐和水,所以W为Na,X为Al,Na与Y形成Na2Y,说明Y为-2价,即Y为S,则Z为Cl。
答案:(1)Al(OH)3+OH-=AlO2-+2H2O。
(2)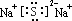
(3)酸
Al3++3H2O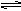 Al(OH)3+3H+。
Al(OH)3+3H+。
(4)SO2+Cl2+2H2O=H2SO4+ 2HCl。
(5)HCl>H2S。
(6)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJmol-1。
23.(08全国Ⅱ卷)Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,
(1)Q的最高价氧化物,其固体属于________晶体,俗名叫_____________。
(2)R的氢化物的分子的空间构型是_____________,属于____________分子(填“极性”或“非极性”),它与X形成的化合物可作为一种重要陶瓷材料,其化学式是___________。
(3)X的常见氢化物的空间构型是____________;它的另一种氢化物X2H4是一种火箭燃料的成分,其电子式是__________。
(4)Q分别与Y、Z形成的共价化合物的化学式是_______和_______;Q与Y形成的分子的电子式是____________,属于______________分子(填“极性”或“非极性”)。
解析:Q的低价氧化物与X单质分子的电子总数相等,Q可能为C(碳),X为N,由于这五种元素均是前20号元素,所以R为Si,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z,Y为S,Z为Cl。
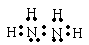 答案:(1)分子;干冰。
答案:(1)分子;干冰。
(2)正四面体;非极性;Si3N4。
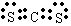 (3)三角锥;
。
(3)三角锥;
。
(4)CS2;CCl4。 ;非极性。
22.(08重庆卷)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 。
解析:X、Y组成的化学式为XY2,且为离子化合物,所以X为+2价,Y为-1价,设Y的电子数为a,则X为a+3,所以2a+a+3=54,a=17,Y为Cl,X为Ca。D与Cl相邻,D的最外层电子数是电子层数的三倍,所以D为S,E为C。W与Cl同周期,其单质是原子晶体,所以W为Si元素Z的单质Z2有3个共价键,Si与Z能形成一种新型无机非金属材料,所以Z为N。
答案:(1)CaCl2。
 (2)
(2)
S=C=S;H2S。
(3)Si3N4。
(4)2F2+2OH-=2F-+OF2+H2O。
21.(08山东卷)氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的
键比
键稳定(填“ ”“
”“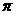 ”)。
”)。
(3)(CH3)3NH+和AlCl-4可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
 a、助燃剂
b、“绿色”溶剂
a、助燃剂
b、“绿色”溶剂
c、复合材料 d、绝热材料
(4)X*中所有电子正好充满K、L、M三个电子层,它与N3-形成
的晶体结构如图所示。X的元素符号是 ,与同一个
N3-相连的X*有 个。
答案:(1)1s22s22p6
(2)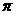

(3)小 b
(4)Cu 6
20.(08江苏卷)
A. 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4 HBr+NaHSO4
①
HBr+NaHSO4
①
R-OH+HBr R-Br+H2O
②
R-Br+H2O
②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下;
|
|
乙醇 |
溴乙烷 |
正丁醇 |
1-溴丁烷 |
|
密度/g·cm-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
|
沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”);其原因是
。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,起目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
答案: A.(12分)
(1)C<O<N (2)三角锥形 sp3
(3)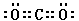 N2O
N2O
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
B.(12分)
(1)d
(2)小于;醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键。
(3)下层
(4)abc
(5)c
(6)平衡向生成溴乙烷的方向移动(或反应②向右移动)
19.(08海南卷)根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有___________(填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是____________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)______________;
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
答案:(1)7;K2O、K2O2(KO2也可以)。
(2)He、Ne、Ar。
(3)C、H。
(4)Na。
18.(08海南卷)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的:
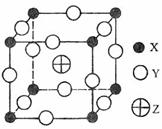
A.ZXY3
B.ZX2Y6
C.ZX4Y8
D.ZX8Y12
解析:根据晶胞计算X为8个那么X的个数=8×1/8=1,Y为12个,那么Y=12×1/4=3,Z为1个,故化学式为ZXY3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com