
题目列表(包括答案和解析)
26.(广州市调研)(12分)工业制硫酸的核心反应是 :2SO2(g) + O2(g)  2SO3(g) △H<0,回答下列问题:
2SO3(g) △H<0,回答下列问题:
(1)此反应的平衡常数表达式为K= ,随着温度的升高,上述平衡常数
(填“增大”、“减小”或“不变”)。
(2)将一定量的SO2(g)和O2(g)放入1L密闭容器中,在一定条件下达到平衡,测得SO2为0.11mol,O2为0.05mol,SO3为0.12mol。计算该条件下,反应的平衡常数K=
。
SO2的转化为SO3转化率= 。
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是 (填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可先用氨水吸收,再用硫酸处理。
①反应的化学方程式为 ,
②这样处理的优点是 。
26.(10分)(1)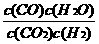 ;(2分) ;(2)放热;(2分)
;(2分) ;(2)放热;(2分)
(3)B、C; (3分,若只选一个对的得1分,全对得3分)
(4)设3min-4min达到平衡时CO、H2 O的平衡浓度为c3, 则CO2 、H2的平衡浓度分别为0.200-c3和0.300- c3
根据: K= c3·c3/(0.200-c3)·(0.300-c3)= 1 (1分)
c3=0.120mol/L (1分,写0.12的不给分) ;
CO2 (g)的转化率 : 0.120/0.2×100% = 60% (1分)
26.(惠州二模)(10分)在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)  CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ; (2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g)
 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2
(mol/L) |
H2
(mol/L) |
CO
(mol/L) |
H2
O ( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
26.(12分)
⑴>(1分),升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应(3分)
⑵①降低反应所需温度,节约能源(2分)
②防止Mg被空气氧化(2分)
⑶A(2分)
(4)CaCO3•MgCO3 CaO•MgO+
2CO2 ↑ (2分)
CaO•MgO+
2CO2 ↑ (2分)
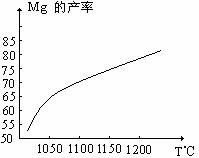
26.(江门调研)(12分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
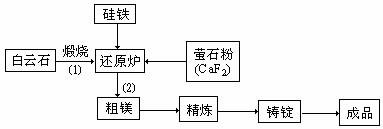
(1)在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的反应热
△H 0(填“<”“>”“=”)理由是 。
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2• 6H2O),其中
KCl•MgCl2• 6H2O属于 。
A.复盐 B.混合物 C.配合物
(4)写出煅烧白云石的反应化学方程式 。
0.(4)(2分)1mol/L<c(A)<0.2mol/L
(若答为:0<c(A)<0.2mol/L,0.1mol/L<0.4mol/L,
只给1分;其它0分) (5)(2分)B
26.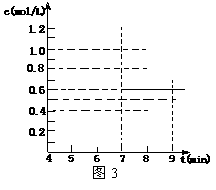
 (10分)(1)(2分)0.1
mol/L·min;
(10分)(1)(2分)0.1
mol/L·min;
(2)(2分) (或0.17);
(3)(2分)①a(1分) ②(参看右图,1分)
26.(广东省肇庆一模)(10分)在某个容积为2.0 L的密闭容器内,在T℃时按下图1所示发生反
应:mA(g)+nB(g) pD(g)+qE(s),DH<0(m、n、p、q为最简整数比)。
pD(g)+qE(s),DH<0(m、n、p、q为最简整数比)。
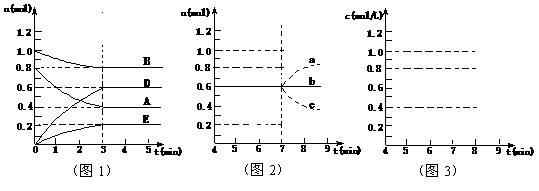

(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为____ _;
(2)该反应的化学平衡常数K的数值为_________________(保留至两位小数);
(3)反应达到平衡后,第7 min时:
①若降低温度,D的浓度变化最可能的是_____(用图2中a~c的编号回答);
②若在7min时仍为原平衡,此时将容器的容积压缩为原来一半,请在图3中画出7 min后D浓度变化情况。
(4)在T℃时,相同容器中,若开始时加入0.2 mol A 、0.8 mol B 、0.9 mol D 、0.5 mol E反应,达到平衡后,A的浓度范围为_______________________。
(5)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
26.(15分)(1)0.3mol·L-1·S-1 0.7mol·L-1(4分)
(2) 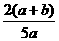 ×100%(2分) 、
×100%(2分) 、
(3)85.7%(2分)减小 (1分) 升高温度 充入A气体 减小压强(2分)
(4)t1-t2 t3-t4降低温度(2分) 图(2分)
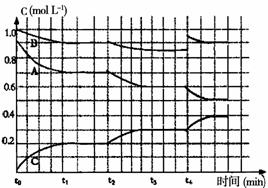
26.(东莞一模)(15分)有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有___________________________ 。

(4)右图是一定条件下该反应过程中,体系内各物 质浓度的变化情况。反应处于平衡状态的时间是________________,t2时曲线发生变化的原因是________________________________ ,若在t4时将B的浓度增大0.lmol·L-1,请在上图中画出各物质浓度的变化情况。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com