
题目列表(包括答案和解析)
18.(潮州二模)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高或 最低化合价 |
-2 |
+2 |
+1 |
+5 -3 |
+7 -1 |
+1 |
+5 -3 |
+3 |
下列说法正确的是:
A.元素④的原子序数小于元素⑦的原子序数
B.②、③处于同一周期
C.上述八种元素最高价氧化物对应的水化物中,⑤号酸性最强
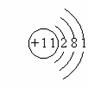
D.⑧号元素原子结构示意图为:
14.(潮州二模)在一定条件下,RO3-与R-发生如下反应:RO3-+5R-+6H+=3R2+3H2O。Q元素与R元素同族,且均为短周期元素。下列说法正确的是
A.R、Q是VA族元素
B.R的氢化物的沸点高于Q的氢化物的沸点
C.R、Q的氢化物是含有极性键的极性分子
D.R的最高价氧化物的水化物的酸性强于H2SO4
9.(潮州二模)关于下列粒子的描述不正确的是
A.PH3的电子式为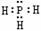 ,其热稳定性不如NH3
,其热稳定性不如NH3
B.HS-的电子式为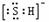 ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C.CH2Cl2的电子式为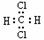 ,是分子结构呈四面体的分子
,是分子结构呈四面体的分子
D.KF的电子式为K+ ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
2.(潮州二模)13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
15、(肇庆二模)下列叙述中,结论(事实)和对应的解释(事实)均不正确的是
A.金刚石的熔沸点高于晶体硅,因为C-C键能大于Si-Si键能
B.二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构
C.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
D.空间构型为正四面体结构的分子中,化学键的键角不一定是109028’,有可能为600
11、(肇庆二模)A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,
B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
8.(肇庆二模)根据元素周期律分析下面的推断正确的是:
①铍(Be)的最高价氧化物的水化物可能具有两性;②钛与铝是同族元素,性质相同;③砹(At)为有色固体,HAt不稳定;④锂(Li)在氧气中剧烈燃烧,产物是Li2O2;⑤硫酸锶(SrSO4)是难溶于水的白色固体;⑥硒化氢(H2Se)比H2S稳定。
A.①②③④ B.②④⑤ C.①③⑤ D.②④⑥
1.(肇庆二模)2H、13C、15N、18O、34S等常用做环境分析指示物,下列对它们的说法正确的是
A.34S原子核内的中子数为16 B.16O与 18O互称同位素
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
19.(揭阳一模)近年用红外激光技术研究液氢,发现范德华力也可以引起微粒间反应,已知在液氢中有氢分子和质子形成的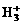 离子,其构型为等边三角型,属于二电子三中心离子。同时
离子,其构型为等边三角型,属于二电子三中心离子。同时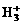 和氢分子可进一步形成
和氢分子可进一步形成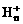 。有关判断正确的是
。有关判断正确的是
A.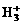 的电子式为
的电子式为
B.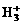 可进行反应,在液态氢中形成
可进行反应,在液态氢中形成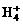 、
、 、
、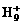
C.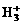 可在液态氢中形成
可在液态氢中形成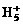 、
、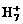 、
、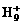
D.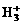 广泛存在于固态、液态和气态氢中
广泛存在于固态、液态和气态氢中
14.(揭阳一模)常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是
 A.S8转化为S6、S4、S2属于非氧化还原反应
A.S8转化为S6、S4、S2属于非氧化还原反应
B.不论哪种硫分子,完全燃烧时肯定都生成SO2
C.常温条件下单质硫为原子晶体
D.把硫单质在空气中加热到750℃即可得到S2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com