
题目列表(包括答案和解析)
27.(潮州二模)(1)图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第
族。

图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是a还是b?并说出理由: 。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
 II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、 话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 。
。
则绿色晶体配合物的化学式为 。
22.(共8分)(1) 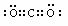 或
或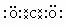 (2分)
(2分)
(2) CO32-+H2O HCO3-+OH-(只用文字叙述,不写方程式不给分)(2分)
HCO3-+OH-(只用文字叙述,不写方程式不给分)(2分)
(3) ①4H++AlO2―= Al3++2H2O;(2分)
②2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑(2分)
22、(潮州二模)(共8分)有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大。B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。甲、乙、丙、丁四种物质之间的相互反应关系如下图:

请回答: (1)写出A的最高价的氧化物的电子式____________。
(2)用有关化学用语解释:丙溶液呈碱性的原因________________________________。
(3)写出有关反应的离子方程式:
①甲溶液+乙溶液: ;②丁溶液+丙溶液: 。
19.(共13分,每空1分)
(1)探究同周期元素性质的递变规律
(2)①试管;②烧杯;③酒精灯。
(3)1B 2F 3A 4D 5C 6E Cl2 +H2S==2HCl+S↓; Al3++4OH- ==[Al(OH)4]-
(4)金属性:Na>Mg>Al 非金属性:Cl>S
19、(深圳市宝安区二模)(13分)某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表。
|
实验操作 |
实验现象 |
|
1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 (B)产生气体,可在空气中燃烧,溶液变成浅红色 (C)反应不十分强烈,产生的气体可以在空气中燃 烧 (D)剧烈反应,产生可燃性气体 (E)生成白色胶状沉淀,进而沉淀消失 (F)生成淡黄色沉淀 |
|
2.向新制的H2S饱和溶液中滴加新制的氯水 |
|
|
3.钠与滴有酚酞试液的冷水反应 |
|
|
4.镁带与2
mol.L-1的盐酸反应 |
|
|
5.铝条与2
mol.L-1的盐酸反应 |
|
|
6.向AlCl3溶液滴加NaOH溶液至过量 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。
(2)实验用品:仪器:① ② ③ ④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸 ⑨胶头滴管等
药品:钠、镁带、铝条、2 mol.L-1的盐酸、新制的氯水、饱和的H2S溶液AlCl3溶液、NaOH溶液等。
(3)请你写出上述的实验操作与对应的现象
1 2 3 4 5 6 (用A-F表示)
写出实验操作2、6的反应离子方程式
实验2 ,
实验6 ,
(4)实验结论: 。
27.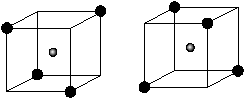 (共10分)(1)
(共10分)(1)
(2)HF可与水形成氢键,且是极性分子;
 (3)
极性
(3)
极性
(4)2H2O2 2H2O+O2↑
2H2O+O2↑
(5)CH4O(答CH3OH不扣分)(每问2分)
27、(深圳市宝安区二模)(10分)已知A、B、C、D和E 5种分子所含原子的数目依次为5、2、3、4和6,且都含有18个电子。又知A、C和D都是由两种元素的原子组成,B是只由一种元素原子构成的双原子分子,请回答:
(1)组成A分子的某一原子位于立方体的中心,请在立方体的顶点上用黑点画出其余四个原子的位置.

(2)B可与水发生反应,产物之一极易溶于水。该产物极易溶于水的原因是:
(3)C分子的电子式为_______,属于__________分子(填“极性”或“非极性”).
(4)若向D的稀溶液中加入少量二氧化锰,有无色气体生成.则该反应的化学方程式是______________________________________________.
(5)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是_____________.
28.(1)1s22s22p3
(2)NH4++H2O=NH3H2O+H+
(3)NH4HCO3 [或(NH4)2CO3] CH2(NH2)COOH
(4)

28.(珠海市万山区二模)短周期的四种元素A、B、C、D,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3︰4。请回答:
(1)写出C原子的核外电子排布式 ;
(2)由四种元素中的三种组成的甲、乙两种化合物,甲属于盐类,其溶液呈酸性,请用离子方程式表示其溶液呈酸性的原因 ;
(3)丙、丁两种化合物,它们均含上述四种元素,既可以与盐酸反应又可以与NaOH溶液反应,丙为无机盐,其化学式为 ,丁为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 ;
(4)A和B组成的化合物M,分子中A与B的原子个数比是3︰1,常温常压下,0.5 mol M完全燃
烧放出780 kJ的热量,请写出表示M燃烧热的热化学方程式: 。
27.(珠海市万山区二模)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的重要条件及生成的水已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常见的氮肥。(d)化合物L可用于漂白,可由Cl2与NaOH溶液反应制得。(e)化合物J由C、D两种元素组成,其相对分子质量为32。


请按要求填空:
(1)反应③的化学方程式 ;
(2)C的结构式 ;H的化学式 ;
(3)L溶液与化合物E反应的离子方程式 。
(4)化合物J的化学式 。
27.(1)2NH3 + H2SO4 ==(NH4)2SO4;(2)N≡N;(NH4)2SO3(或NH4HSO3);
(3)ClO-+ SO2 + 2OH- = SO42-+ Cl- + H2O (4)N2H4 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com