
题目列表(包括答案和解析)
27.(10分)
(1)Ar (1分) E是CH3OH,CH3OH形成分子间氢键(1分)
(2)V形(或角形或其他合理答案),(1分)极性分子。(1分)
(3)N2O4 + 2N2H4 = 3N2 + 4H2O(1分)
(4)CO中第一个π键的键能比N2的小很多,CO的第一个键容易断。(1分)
(5)1,2(1分)
(6)3d84s2(1分),分子晶体(1分),CO(1分)。
28(A)(广东佛山市南海区调研)(10分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
|
|
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
|
|
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的常见化合物的晶体类型是________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(5) 1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。
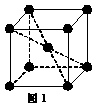
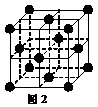
在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________, 转变温度前后两者的密度比(1183 K以下与1183 K以上之比)___________。(用根号表示)
28(A)(10分)
(1)⑨ (1分) (2)苯 (1分) 分子晶体 (1分)(3) 1 (1分)三角锥形 (1分)(4) Be(OH)2+2NaOH=Na2BeO2+2H2O (1分)(5)8 (1分)12 (1分)  (2分)
(2分)
27、(佛山二模)(10分)原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
|
|
|
A-B |
A=B |
A≡B |
|
CO |
键能(kJ/mol) |
357.7 |
798.9 |
1071.9 |
|
键能差值(kJ/mol) |
441.2
273 |
|||
|
N2 |
键能(kJ/mol) |
154.8 |
418.4 |
941.7 |
|
键能差值(kJ/mol) |
263.6
523.3 |
(5)它们的分子中都包含_______个σ键,_________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型);Fe(CO)5是配合物,配体是__________ 。
27.(10分)(1)1S22S22P63S23P4
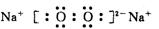 (2分)
(2分)
(2)<(1分)
(3)正四面体;SP3;分子(3分)
(4)H2O分子间存在氢键(1分)
(5)1∶2(1分);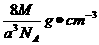 (2分)
(2分)
39.(湛江二模)现有A、B、C、D、E五种短周期元素,其中元素A、B、C组成的化合物俗称“烧碱”,D是最重要半导体材料,它的高纯度单质是制造电脑CPU芯片的主要材料,而E的单质是一种常用于杀菌消毒的气体。有关高纯度D单质的生产流程如下:
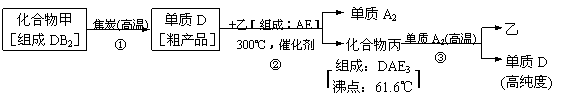

试回答下列问题:
(1)E-的核外电子排布式为______________________,C2B2的电子式为______________。
(2)电负性:D元素__________E元素。(填:“>”、“<”或“=”)
(3)预测D的氢化物的空间构成的空间构型为_______________,化合物丙中的D元素原子轨道发生的是______________杂化,固态时丙属于_______晶体。
 (4)化合物A2B的沸点高于化合物乙的沸点的主要原因是___________。
(4)化合物A2B的沸点高于化合物乙的沸点的主要原因是___________。
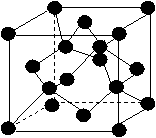
(5)已知D单质的结构与金刚石类似,如右图所示。则该晶体中D原子数与D-D单键的数目比为_____________,该晶胞的边长为a(单位:cm),D的摩尔质量为M单位:g·mol-1),阿佛加德罗常数为NA,则该晶体的密度为_____________g·cm-3。(用代数式表达)
27.(10分)
(1)① A(1分) (多选得0分)
② A(1分) (多选得0分)
③ AlCl3是分子晶体(或AlCl3是共价化合物),熔融状态不能导电(或不电离)。(2分)
(“分子晶体”和“共价化合物”写出其中一个即可。)
(2)1s22s22p63s23p63d74s2 (1分) (或答“[Ar]3d74s2”)
[Co(NH3)5Br]2+ (2分) [Co(NH3)5SO4]+ (2分)
(顺序可以交换,不写“[ ]”不扣分,电荷写错得0分)
BaCl2(或Ba(NO3)2、AgNO3) (1分) (用文字表示不得分)
27.(广州二模)(10分)下表列有几种物质的沸点:
⑴
|
物质 |
AlF3 |
AlCl3 |
AlBr3 |
Al2O3 |
MgCl2 |
MgO |
|
沸点/℃ |
1260 |
181(升华) |
263 |
2045 |
707 |
2850 |
①下列各组物质中,气化或者熔化时所克服的粒子间作用力类型分别与氟化铝和溴化铝相同的是 。
A.NaCl和CCl4 B.Na2O和SiO2
C.金刚石和金属铝 D.碘和干冰
②工业上制备金属镁,应采用电解熔融的 。
A.MgCl2 B.MgO
③工业上制备金属铝,是采用电解熔融Al2O3(加冰晶石),而不是电解熔融AlCl3,原因是 。
⑵过渡元素钴(27Co)的原子核外电子排布式为 。钴有两种化学式均为Co(NH3)2BrSO4的配合物,且配位数均为6。它们分别溶解于水时电离出的阳离子的化学式可能为 和 。鉴别两者的实验方法是:分别取样并滴加 (填化学式)溶液。
22. (10分)
(10分)
(1)Se(1分) (1分)
(2)SiO2+2NaOH==Na2SiO3+H2O(2分) (不配平不得分)
(3)
|
编号 |
性质推测 |
化学方程式 |
|
1 |
还原性(1分) |
H2SeO3 + Br2 + H2O
= H2SeO4
+ 2HBr (2分) |
|
2 |
酸性(1分) |
H2SeO3 + 2NaOH = Na2SeO3
+ 2H2O (2分) |
(或其它合理答案,如“不稳定性”,但答“漂白性”不得分)
(方程式中Se写为Z不扣分,方程式正确仅仅写错元素符号不扣分。第一个反应用O2、Cl2、KMnO4、H2O2、HNO3、Fe3+等代替Br2且书写正确同样得分。第二个反应用碳酸盐、较活泼金属代替NaOH且书写正确同样得分。若推测不稳定性,方程式为H2SeO3 H2O+SeO2↑,漏写“↑”不扣分。)
H2O+SeO2↑,漏写“↑”不扣分。)
22.(广州二模)(10分)下表是元素周期表主族元素的一部分。
|
W |
X |
Y |
|
|
|
Z |
短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
⑴ Z的元素符号是 ,原子结构示意图中 。
⑵ W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为 。
⑶ 探寻同一主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
|
编号 |
性质推测 |
化学方程式 |
|
示例 |
氧化性 |
H2ZO3+4HI=Z↓+2I2+3H2O |
|
1 |
|
|
|
2 |
|
|
22.(11分)
(1)增加反应物接触面积,提高反应速率和原料的利用率(2分)
4C+SrSO4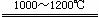 SrS+4CO↑(2分)
SrS+4CO↑(2分)
(2)碳酸锶的溶解度小于硫酸锶的溶解度(1分) 搅拌(1分)
(3)方法一(1分) 硫化锶可溶于水,通过过滤可以除去不溶性杂质(2分)
(4)ABCD(2分,少答一个扣1分)
22.(汕头二模)(11分)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下两种方法制取碳酸锶,进而制得多种锶的化合物。
方法一:将天青石粉碎后在1000℃-1200℃时与碳在还原气氛中反应制得硫化锶。向硫化锶溶液中通入CO2得到碳酸锶。
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热l-2 h,经过滤、洗涤,得到碳酸锶。
(1)方法一将天青石粉碎的目的是________________________________________。写出用碳还原天青石反应的化学方程式:___________________________________________。
(2)方法二的反应能够发生,说明_________________________________________。为了使该反应充分进行,还可以采取的措施是_______________。
(3)两种方法中得到的碳酸锶纯度较高的是_______________(填“方法一”或“方法二”),理由是______________________________________________。
(4)下列关于锶及其化合物的叙述中,正确的是___________。
A.离子半径:Ba2+>Sr2+>Ca2+ >Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2
C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com