
题目列表(包括答案和解析)
15、已知:H2(g)+F2(g) = 2HF(g);△H=-270kJ/mol,下列说法正确的是C
A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270KJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 KJ的热量
14.有关键能数据如表:B
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式: ;△H=-989.2 kJ·mol-1则X的值为
;△H=-989.2 kJ·mol-1则X的值为
A.314.4 B.460 C.548 D.832
13. 白磷和氧气可以发生反应:P4+5O2=P4O10。
白磷和氧气可以发生反应:P4+5O2=P4O10。
已知断裂下列化学键需要吸收的能量分别为:
P-P a kJ/mol、P-O b kJ/mol、P=O ckJ/mol、
O-O d kJ/mol。根据图示的分子结构和有关
数据估算该反应的△H,其中正确的是( A )
A.(6a+5d-4c-12b)kJ/mol
B.(4c+12b-6a-5d)kJ/mol
C.(4c+12b-4a-5d)kJ/mol
D.(4a+5d-4c-12b)kJ/mol
12.已知25℃101kPa下,石墨和金刚石燃烧的热化学方程式如下
C(石墨)+O2(g) CO2(g); △H=-393.51kJ·mol-1
C(金刚石)+O2(g) CO2(g); △H=-395.41kJ·mol-1
下列关于C(石墨) C(金刚石)的焓变△H及有关叙述正确的是 ( A )
A.△H >0;等质量时石墨能量比金刚石低
B.△H >0;等质量时石墨能量比金刚石高
C.△H <0;等质量时石墨能量比金刚石低
D.△H <0;等质量时石墨能量比金刚石高
11.甲醇属于再生能源,可代替汽油作为汽车燃料。下列能正确表示甲醇燃烧热的热化学方程式为 ( B )
A.CH3OH(1)+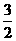 O2(g)=CO2(g)+2H2O(1) △H=+763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=+763.3kJ·mol-1
B.CH3OH(1)+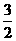 O2(g)=CO2(g)+2H2O(1) △H=-763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=-763.3kJ·mol-1
C.CH3OH(1)+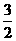 O2(g)=CO2(g)+2H2O(1) △H=-675.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=-675.3kJ·mol-1
D.2CH3OH(1)+3 O2(g)=2CO2(g)+4H2O(1) △H=-1526.6kJ·mol-1
10. 下列变化属于放热反应的是 ( D )
下列变化属于放热反应的是 ( D )
A.H2O(g)=H2O(1) △H=-44.0kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9kJ/mol
C.形成化学键时放出能量的化学反应
D.能量变化如右图所示的化学反应
9.燃烧1g液态有机物,只生成0.05molCO2气体和1.2g液态水,且放出热量33.63kJ,该有机物的蒸汽对H2的相对密度为30,则该有机物燃烧的热化学方程式为(A)
A.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(l); △H=-2017.8kJ/mol
B.C3H8 (l)+5O2(g)=3CO2(g)+4H2O(l); △H=-33.63kJ/mol
C.C3H8(l)+5O2(g)=3CO2(g)+4H2O(l); △H=-1479.4kJ/mol
D.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(g); △H=-2017.8kJmol
5、2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为:2221.5 kJ/mol;正丁烷的燃烧热为:2878 kJ/mol;异丁烷的燃烧热为:2869.6 kJ/mol;下列有关说法正确的是 ( D )

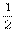 O2(g)==CO(g);△H=-393.5 kJ/mol
O2(g)==CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)==2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)==CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D. C6H12O6(s)+3O2(g)
=== 3CO2(g)+3H2O(1);△H=-1400 kJ/mol
C6H12O6(s)+3O2(g)
=== 3CO2(g)+3H2O(1);△H=-1400 kJ/mol
4、已知:(l)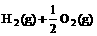 =H2O(g) △H1=a
kJ·
=H2O(g) △H1=a
kJ·
(2)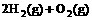 =2H2O(g) △H2=b
kJ·
=2H2O(g) △H2=b
kJ·
(3)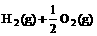 =H2O(l) △H3=c
kJ·
=H2O(l) △H3=c
kJ·
(4)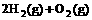 =2H2O(l) △H4=d
kJ·
=2H2O(l) △H4=d
kJ·
下列关系式中正确的是 C
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
3、同温同压下,下列各组热化学方程式中,满足Q2>Q1的是 A
A. 2H2(g) + O2(g) = 2H2O(g); △H =-Q1
2H2(g) + O2(g) = 2H2O(l); △H =-Q2
B. S(g)+O2(g)=SO2(g); △H =-Q1
S(s)+O2(g)=SO2(g); △H =-Q2
C. C(s)+O2(g)=CO2(g); △H =-Q1
C(s)+1/2O2(g)=CO(g); △H =-Q2
D. H2(g)+Cl2(g)=2HCl(g); △H =-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g); △H =-Q2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com