
题目列表(包括答案和解析)
17.(15分)硝酸钾在水里的溶解度是指在一定温度下,硝酸钾在100g水中达到饱和状态时能溶解的克数。它随温度的升高而增大,随温度的降低而减小。把一定量硝酸钾在较高温度下溶于一定量的水中,当温度降到溶液里刚有晶体析出时,这时的温度可作为饱和溶液的温度(或在恒温下制成饱和溶液)。根据测得的温度和已知硝酸钾及水的量,就能算出硝酸钾在某一温度的溶解度。
[实验步骤] (1) 准确称量(天平)干燥的蒸发皿的质量并记录为m1g;
(2) 在恒温水浴加热下,配制硝酸钾饱和溶液;
(3) 取一定量的硝酸钾饱和溶液用倾析法倾入蒸发皿中,称量并记录为m2g;
(4) 加热蒸发皿中的溶液至蒸干,放入干燥器内冷却后称量并记录为m3g;
(5) 根据上述公式计算S;
(6) 重复上述操作,取两次测定结果的平均值。
根据实验,回答下列问题:
(1) 配制硝酸钾的饱和溶液时,必须水浴加热,原因是_________________。
(2) 请在答卷方框内画出制取硝酸钾饱和溶液实验装置图,并注明容器内的所用试剂。(铁架台、铁夹、石棉网、酒精不需要画出)
 为了保证溶液达到饱和,实验操作是_______________________。 如果实验过程中把蒸发皿放在空气中冷却,没有在干燥器中冷却,会造成实验结果________(“偏高”、“偏低”、“不变”);使用温度计时仰视温度计刻度读数,会造成实验结果________(“偏高”、“偏低”、“不变”)。
为了保证溶液达到饱和,实验操作是_______________________。 如果实验过程中把蒸发皿放在空气中冷却,没有在干燥器中冷却,会造成实验结果________(“偏高”、“偏低”、“不变”);使用温度计时仰视温度计刻度读数,会造成实验结果________(“偏高”、“偏低”、“不变”)。
(3) 请计算在该温度下溶解度为s=______________________________
(4) 右图中A点表示t℃时该溶液为_____________(“饱和”、“不饱和”)溶液,欲将A点的溶液恢复到饱和溶液,应采取的措施是①_____________________,②______________(写两条)
(5)如果硝酸钾中含有少量氯化钠杂质,如何除去,请扼要写出实验步骤_______。
15.(9分)铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为c g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
14. (12分) 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2====2MgO+C)
(12分) 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2====2MgO+C)
Ⅰ、用如图所示的装置进行Mg和SO2的实验:
 (1)选择制取SO2的合适试剂
。
(1)选择制取SO2的合适试剂
。
①10%的H2SO4溶液;
②80%的H2SO4溶液;
③Na2SO3固体;
④CaSO3固体
(2)写出装置B中发生的主要反应的化学方
程式:
(3)你认为该装置是否有不足之处? ,如果有,请列出两点:
。
Ⅱ、某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料后得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si; ②Mg在高温的条件下即可与SiO2反应;
③金属硅化物与稀H2SO4反应生成硫酸盐和SiH4;④Si和SiO2均不与稀H2SO4反应; ⑤SiH4在空气中自燃。
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀H2SO4溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀H2SO4溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制“Si”的化学方程式是
(5)你估计“用稀H2SO4溶解固体产物时,发现有爆鸣声和火花”的原因是
13.(14分)N2在化工生产、农业、医疗、航天航空等诸多领域用途广泛。某化学兴趣小组同学为探究在实验室制备较为纯净N2的方法,进行了认真的准备。请你参与交流与讨论。
[查阅资料] N2的制法有下列三种方案:
方案1:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉。
方案2:加热NaNO2和NH4Cl的浓溶液制得N2。
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2。
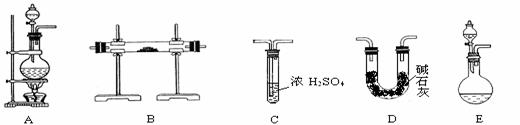 [实验准备]
以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出)。
[实验准备]
以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出)。
[分析交流]
(1)若按方案1制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的顺序连接的顺序是(填写序号,下同)________ 。
获得N2的反应原理是(写反应方程式)_________________________________。
(2)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气法,其原因是
____________________________。你提出的收集方法是__________________。
(3)若以方案2制得N2,应选择的发生装置是__________。为保证实验安全顺利进行,操作时应____________________________________________________(填写两点)。
(4)上述三个方案中,制得的N2纯度最差的是__________。在N2纯度要求不甚严格的情况下,有人建议将方案1和方案3结合使用,你认为其优点是______________ 。
12. (10分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
(10分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
[实验1]:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
[实验2]:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
|
序号 |
操 作 |
现 象 |
|
① |
滴入稀硝酸溶液 |
沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
|
② |
滴入稀硫酸溶液 |
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
[有关资料]常见铜的化合物颜色如下:
|
物质 |
颜
色 |
物质 |
颜 色 |
|
氯化铜 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
氢氧化亚铜 (不稳定) |
橙黄色 |
|
碱式氯化铜 |
绿色 |
氢氧化铜 |
蓝色 |
|
氧化亚铜 |
砖红色或橙黄色 |
氯化亚铜 |
白色 |
请回答下列问题:
(1)铜的常见正化合价为 、 ,最终试管底部橙黄色沉淀的化学式
(2)阴极上发生的反应为:
阳极上发生的反应为:
(3)写出实验2中①、②的离子方程式
①
②
11.(9分)小智同学有次实验时把SO2通入装有BaCl2溶液的试管中,出现了白色浑浊物。
(1)小智查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。
你认为他所查阅的数据为:SO2饱和溶液中各离子的浓度和 。
(2)小智对白色浑浊物的成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
|
|
假设 |
实验验证方法及现象 |
|
假设1 |
白色浑浊物是BaSO3。 |
。 |
|
假设2 |
白色浑浊物是BaSO4,造成原因是
。 |
把BaCl2溶液煮沸,冷却后滴加苯液封,再通入SO2。出现轻微浑浊。 |
|
假设3 |
白色浑浊物是BaSO4,造成原因是
。 |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中。 不出现浑浊。 |
请把上表填充完全。
(3)请你再提供一种假设。白色浑浊物是BaSO4,造成原因是 。
(4)写出在验证假设2的实验时,溶液中发生的反应的化学方程式。
、 。
10.(11分)下表是稀硫酸与某金属反应的实验数据:
|
实验 序号 |
金属质量/g |
金属 状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因 。
9.(14分)某化学探究学习小组设计如下图装置制取硝酸(夹持和加热仪器均已略去)。实验中可供使用的药品有:Na2CO3、NaHCO3、(NH4)2CO3、NH4HCO3、Na2O2、NaOH溶液和水。
请回答下列问题:
(1)装置C中发生反应的化学方程式是 。
装置D中发生反应的化学方程式是 。
(2)撤去装置C中的加热装置后,铂丝仍然保持红热,这是因为:
。
(3)实验过程中,要使NH4HCO3充分转化为HNO3,还要在装置C中通入氧气。利用上述药品制取氧气,可以最好选用下列装置中的 。(填序号)

① ② ③
(4)装置E中盛放的是 溶液,其作用是 。
(5)实验中,为了省略制氧气的装置,可以在A中再加入上述提供药品中的一种物质,它是 。
8.(11分)
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。

[探究一]实验方案:铝镁合金 测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
(1) 过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质
量分数将 (“偏高”或“偏低”)
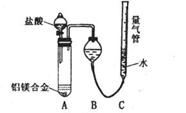

[探究二]实验方案:铝镁合金 测定生成
气体的体积,实验装置如右图,问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间
添加一个干燥、除酸雾的装置。你的意见是:
(填“需要”或“不需要”)。
(2) 为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
① ②
 [探究三]实验方案:称量x g铝镁合金粉末.放在如右图
[探究三]实验方案:称量x g铝镁合金粉末.放在如右图
所示装置的惰性电热板上,通电使其充分灼烧。问题讨论:
(1) 欲计算Mg的质量分数,该实验中还需
测定的数据是
(2)若用空气代替O2进行实验,对测定结果是
否有影响? (填“是”或“否”)。
[实验拓展] 参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。(书写形式可以模仿探究一、二)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com