
题目列表(包括答案和解析)
22.(15分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称取a g样品,置于烧杯中;
②加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
 (1)上图仪器中,实验步骤①②③中必须用到的仪器是E和
(填仪器序号)。
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和
(填仪器序号)。
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 。
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为 。
21.(15分)碱式碳酸镁和无水氯化镁具有广泛的用途。
 ●用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
●用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3·n Mg(OH)2·x H2O)的组成。某同学组装仪器如图所示:

(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是 。
(5)若将E框中的装置去掉,对实验结果m的值影响是 (填‘偏大’或‘偏小’或‘不变’)
20. ①﹙8分﹚ 现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,实验开始时只先称量干事燥管的质量,请完善下列实验: (可用试剂:浓硫酸、碱石灰):
a样品称量 、b高温分解 、c 、d e 、MgO称量
若18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a 、 b 和c分别为
②.将 Mg、Si、Al的混合物均分成两等份,一份加入过量稀盐酸产生气体V1ml,另一份加入过量的氢氧化钠溶液产生气体V2ml﹙相同条件下﹚,若V1=V2,则Mg和Si的物质的量之比为 。
19.(12分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因
可能是___________。(填序号)
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开
始阶段产生气体的速率不断加快的原因是
。
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
|
选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
|
A |
负极 |
NaOH |
2Al-6e-+8OH-=2AlO2-+4H2O |
6H2O+6e-=6OH-+3H2↑ |
|
B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
|
C |
正极 |
浓硝酸 |
Mg+2e-=Mg2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
其中正确的是__ __(填序号),由此推知,金属作电极不仅与本身性质相关,而且与__ __有关。
5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试
管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙 E.双氧水 F.硝酸银
18.(10分) X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢
化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
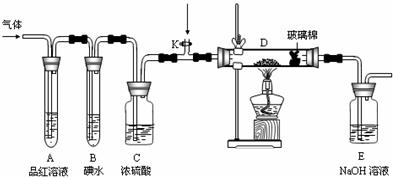
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不
相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为
;若装置D中装的是五氧化二钒,当通入足
量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了
17、镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:

回答下列问题:
(1) 工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
。
(2) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:
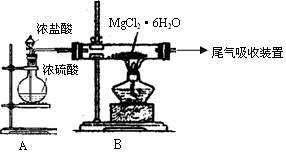
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式 。
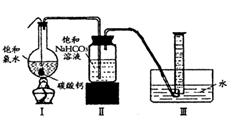 在圆底烧瓶底部,有一用塑料网包住的过量块状碳
在圆底烧瓶底部,有一用塑料网包住的过量块状碳
酸钙和150mL饱和氯水,按如图所示装置实验,待不
再产生气泡后,将塑料网中剩余的石灰石提出液面,
密封后再加热、煮沸烧瓶中的液体,直到量筒中的气
体不再增加(不考虑HClO的分解)。请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造
成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现B/22.4 moL明显小于A/100 moL。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是 。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是 。
16.(12分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
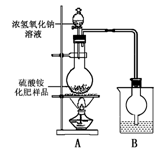 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械性杂质。
[实验探究]
按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:
烧杯中盛放的试剂最好是 (填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是”或“不是”)一等品
 ①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。请回答:
(1)反应后所得的溶液漂白性增强的原因是 。
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有 。
18.(14分)某校化学兴趣小组利用下列实验装置探究SO2的性质,先打开K1,关闭K2。进行实验,请回答下列问题。

(1)装置A中发生反应的化学方程式为 ;
(2)装置E、F、G中溶液颜色都褪去了,但原因却不同。E褪色是因为SO2具有 ,F中发生反应的离子方程式为 ,G中发生反应的离子方程式为 。
(3)实验完毕,关闭K1,装置B可以贮存多余气体,则B中广口瓶内应盛装的液体是 ;
①水 ②碳酸钠溶液
③饱和碳酸氢钠溶液 ④四氯化碳
⑤饱和亚硫酸氢钠溶液
(4)装置D中无明显现象,欲使D中产生白色沉淀,关闭K1,打开K2,可将C中贮存的气体注入D中即可。则C中贮存的气体为 ,此时D中发生反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com