
题目列表(包括答案和解析)
15.(6分)滴定度是指每毫升标准溶液相当于被测定物质的克数,通常用T表示。例如,T=0.056 g/mL,表示每毫升某标准硫酸溶液恰好与0.056 g氢氧化钾完全反应。
(1)若某标准盐酸溶液对碳酸钙的滴定度为0.05 g/mL,该盐酸溶液的pH为多少?
(2)某不纯的硝酸银样品中Ag+的质量分数为a,取一定质量的该样品溶于水,并用上述盐酸滴定达终点,恰好消耗盐酸a mL,则该盐酸对该硝酸银样品的滴定度T为多少?
(3)某碳酸钠样品中可能混有氢氧化钠和碳酸氢钠,若以酚酞为指示剂(该指示剂变色范围为pH为8-10)。仍用上述标准盐酸溶液滴定,已知盐酸对碳酸钠样品的滴定度为0.073 g/mL,试通过计算确定该样品的成分及碳酸钠的纯度。
13.(10分)有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按下图所示方式在电路中连接。闭合开关K后,测得各支路电流强度IⅠ≈IⅡ(其中IⅡ略小)。
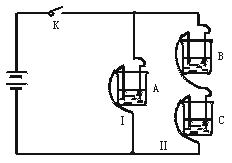
若撤去B,测知电流强度IA《IC;若撤去C,并将A、B两溶液混匀后均分为两等份,再重置于电路Ⅰ、Ⅱ处,测知通过A、B混合溶液的电流强度与先前通过A溶液的电流强度的相对大小关系为:IAB》IA。
已知A、B、C分别选自下列溶液:0.1 mol·L-1盐酸、0.1 mol·L-1醋酸、0.1 mol·
L-1 NaCl溶液、0.1 mol·L-1硫酸、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1氨水,且25℃时A溶液pH<7。
(1)指出A、B、C是(或可能是)什么溶液?
A ;B ;C 。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是 ;将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离度最大 (填“A”“B”或“C”)。
12.(12分)水的电离平衡曲线如下图所示。
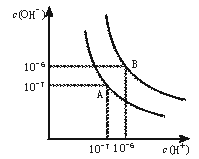
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积为 。
11.(10分)25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”) ,其理由是 。
(2)a值可否等于5(填“可”或“否”) ,其理由是 。
(3)a的取值范围是 。
10.(4分)在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是 。
9.在浓度为c mol·L-1的AgNO3溶液a mL中加入一定量pH=1的盐酸时,恰好使溶液中Ag+完全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是
A.0.0020 B.0.011
C.0.11 D.0.22
8.下列各项数据中,其比值为2∶1的是
A.pH等于7的氨水与硫酸铵的混合溶液中c(NH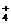 )与c(SO
)与c(SO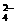 )之比
)之比
B.相同温度下,0.2 mol·L-1的HCOOH溶液与0.1 mol·L-1的HCOOH溶液中c(H+)之比
C.Na2S溶液中c(Na+)与c(S2-)之比
D.pH=12的KOH溶液与pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比
7.某温度下,重水(D2O)的离子积常数KW=c(D+)×c(OD-)=1.6×10-15。可以用pH同样定义pD=-lgc(D+)。以下关于pD的叙述正确的是
A.中性溶液的pD=7.0
B.含0.01 mol的NaOD的D2O溶液1 L,其pD=12.0
C.溶有0.01 mol DCl的D2O溶液1 L,其pD=2.0
D.在100 mL 0.25 mol·L-1的DCl的重水溶液中,加入50 mL 0.2 mol·L-1的NaOD的重水溶液,最后溶液pD=1.0
6.下列四种溶液中,由水电离生成的氢离子浓度之比(①∶②∶③∶④)是
①pH=0的盐酸?②0.1 mol·L-1的盐酸?③0.01 mol·L-1的NaOH溶液?④pH=11的NaOH溶液
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com