
题目列表(包括答案和解析)
3.A 4.A 5.A 6.B 7.D 8.A 9.C
C中因是通过量CO2,故产物不能有CaCO3。
答案:D
2.解析:A中电荷不守恒。C中因在硝酸溶液中,不能得H2S气体。D中氨水是弱电解质。
答案:B
16.(8分)已知在酸性条件下有如下关系:①KBrO3能把KI氧化成I2或KIO3,KBrO3本身被还原为Br2;②Br2能氧化I-为I2;③KIO3能氧化I-为I2;④KIO3能氧化Br-为Br2。在③④反应中KIO3被还原为I2。试回答:
(1)KBrO3、KIO3、Br2、I2氧化性由弱到强的顺序。
(2)现取6 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.4 mol·L-1 KI溶液在稀H2SO4中混合,生成的产物是什么?物质的量之比为多少?
高考能力测试步步高基础训练3答案
15.(6分)IO 与I-在中性或碱性溶液中不起反应,在酸性条件下能起反应生成I2。取KIO3、KI、KHSO4溶液各10 mL,混合后恰好完全反应。反应后用0.1 mol·L-1 Na2S2O3进行滴定,用去Na2S2O3溶液20 mL。反应为:2Na2S2O3+I2===Na2S4O6+2NaI。
与I-在中性或碱性溶液中不起反应,在酸性条件下能起反应生成I2。取KIO3、KI、KHSO4溶液各10 mL,混合后恰好完全反应。反应后用0.1 mol·L-1 Na2S2O3进行滴定,用去Na2S2O3溶液20 mL。反应为:2Na2S2O3+I2===Na2S4O6+2NaI。
(1)写出酸性条件下KIO3与KI反应的离子方程式: 。
(2)KHSO4原溶液的物质的量浓度是多少?
14.(6分)(1)取一株油菜幼苗,放在广口瓶中培养,注入(NH4)2SO4溶液(pH为6.42)在室温下4 h后取出植株,测定溶液的pH为6.01。问:
a.(NH4)2SO4溶液的pH小于7,写出有关离子方程式。
。
b.4 h后(NH4)2SO2溶液pH下降的原因是 。
(2)亚硝酸钠(NaNO2)外观类似于食盐,有咸味,误食造成中毒,试写出亚硝酸钠在酸性条件下氧化FeCl2(氮还原为+2价)的离子方程式: 。
(3)已知大理石可与FeCl3溶液反应(有气体放出),请写出有关化学反应方程式。
(4)工业含铬(Cr2O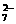 )废水,在酸性条件下,经绿矾处理后,可转变成Cr3+[Cr3+可变成Cr(OH)3沉淀除去]。试写出Cr2O
)废水,在酸性条件下,经绿矾处理后,可转变成Cr3+[Cr3+可变成Cr(OH)3沉淀除去]。试写出Cr2O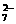 转变为Cr3+的离子方程式。
转变为Cr3+的离子方程式。
13.(5分)用0.2 mol·L-1的H2S溶液100 mL,与0.1 mol·L-1的NaOH溶液300 mL作用,反应的离子方程式为: 。
12.(10分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,写出反应的离子方程式: 。
在以上中性溶液中,继续滴加Ba(OH)2溶液,写出反应的离子方程式: 。
(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,写出反应的离子方程式: 。
在以上溶液中,继续滴加NaHSO4溶液,写出反应的离子方程式: 。
11.(10分)写出下列反应的离子方程式:
(1)高锰酸钾在碱性溶液中与亚硫酸钾反应,生成锰酸钾和硫酸钾及水 。
(2)溴化亚铁溶液久置于空气中,发现溶液由浅绿色逐渐变为黄褐色,并在容器底部出现黄褐色沉淀物 。
(3)已知Ca3(PO4)2、CaHPO4均不溶于水,且Ca3(PO4)2的溶解度比CaHPO4的溶解度小。将0.05 mol·L-1 Ca(H2PO4)2溶液与0.15 mol·L-1 NaOH溶液等体积混合,搅拌后充分进行反应 。
10.(10分)溶液中可能有下列阴离子的一种或几种:Cl-、OH-、S2-、CO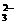 、SO
、SO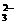 、SO
、SO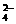
(1)当溶液中有大量H+存在时,则不可能存在 。
(2)当溶液中有大量Ba2+存在时,则不可能存在 。
(3)向溶液中通入足量氯气后, 离子在溶液中不能存在。
(4)当溶液中有 和 阳离子存在时,上述所有阴离子都不可能存在。
9.要配制下列有较多量不同阴、阳离子的四种溶液,其中不能配成的是
A.Ca2+、Al3+、Cl-、CO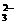
B.Ca2+、Zn2+、Cr2+、Br-
C.Na+、OH-、S2-、Cl-
D.K+、SO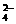 、NH
、NH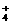 、Cl-
、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com