
题目列表(包括答案和解析)
20、(深圳市宝安区一模)(11分)铝及铝合金经过阳极氧化,铝表面能生成几十微米的较厚的氧化铝膜。
Ⅰ、某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
 b.用水冲洗经有机物擦洗的铝片,浸入60-70℃的2mol/L的NaOH溶液中,以除去原有的氧化膜,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
b.用水冲洗经有机物擦洗的铝片,浸入60-70℃的2mol/L的NaOH溶液中,以除去原有的氧化膜,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
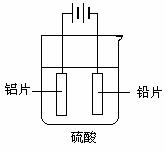
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20-30min,即可得到更加致密的氧化膜。
试回答下列问题
(1)用苯和酒精擦拭铝片的目的: ,
氢氧化钠溶液处理铝片时反应的离子方程式是:
。
(2)阳极的电极反应式为: 。
(3)下列有关说法正确的是 (填序号)。
A.电解时电子从电源负极→导线→铅极,铝极→导线→电源正极
B.在电解过程中,H+ 向阳极移动,SO42-向阴极移动
C.电解过程中溶液的PH基本不变
D.电解时,铝片为阳极,被氧化
Ⅱ、另一小组针对铝表面保护膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期用来盛放和腌制咸菜。究其原因,该小组设计了一个实验以探究其中的原因。他们的实验过程如下:
|
实验 编号 |
实验过程 |
实验现象 |
|
1 |
取一小片铝片于试管中,加入1.0 mol·L-1的盐酸2ml |
30秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失。 |
|
2 |
取一小片铝片于试管中,加入0.5mol·L-1的硫酸2ml |
55秒时开始有少量气泡,然后产生气泡速率加快,最后片铝消失。 |
|
3 |
取一小片铝片于试管中,加入氯化铜稀溶液 |
3分钟左右表面产生少量气泡,且铝表面析出一些红色固体。 |
|
4 |
取一小片铝片于试管中,加入硫酸铜稀溶液 |
一直没有明显的变化 |
你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5mol·L-1的原因是
根据该实验现象,你认为铝制容器不能长期盛放和腌制咸菜的原因是
。
25.(12分)
(1)四周期ⅡB族;MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O ,
Al2O3+6H+=2Al3++3H2O , 加热(每空1分) (2)Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+ (3分) (3)Fe(OH)3,Al(OH)3; (2分,漏写1分)
(4)阴极(1分);Zn2++2e-=Zn(1分) (5)从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。(2分)
25.(广东佛山市南海区调研)(12分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O2 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 2CO ZnO+CO
2CO ZnO+CO Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:

试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做
极,铁极发生的电极反应为 。
(5)试从环境保护和能量消耗的角度评价90年代新工艺相比较有哪些优点
。
23.(10分)
(2)、①Br2 ②Fe3+ (3)、 d 溶液呈血红色, b CCl4层呈无色。(以上每空1分,共6分),(4)、2Fe2++Br2=2Fe3++2Br- (2分) 5、1.2mol/L(2分)
23.(广东佛山市南海区调研)实验探究题(18分)
Ⅰ.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题: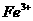 、
、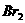 谁的氧化性更强?
谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性: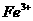 >
>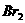 ,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_▲_(填化学式,下同)所致。
,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_▲_(填化学式,下同)所致。
②乙同学认为氧化性: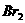 >
> 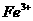 ,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为_▲_。
②在100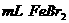 溶液中通入
溶液中通入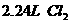 (标准状况),溶液中有1/3的Br-被氧化成单质
(标准状况),溶液中有1/3的Br-被氧化成单质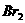 ,则原
,则原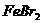 溶液中
溶液中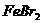 的物质的量浓度为_▲_。
的物质的量浓度为_▲_。
23.(10分)
(1)C (2分)(2)2H2(g)+O2(g)=2H2O(l) △H= -571.6 kJ·mol-1(2分)
(3) ①O2+2H2O+4e-=4OH- (2分)② 0.56(2分)(4)增大(2分)
23、(佛山二模)(10分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资
源可持续利用的制氢气的方法是________。(选填字母)
A.电解水 B.锌和稀硫酸反应 C.光解海水 D.以石油、天然气为原料
 (2)因氢气易燃易爆,贮运安全极为重要。已知氢气的燃烧热为285.8kJ·mol-1。写出其完全燃烧的热化学方程式: 。
(2)因氢气易燃易爆,贮运安全极为重要。已知氢气的燃烧热为285.8kJ·mol-1。写出其完全燃烧的热化学方程式: 。
(3)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验: ① 氢氧燃料电池中,正极的电极反应式为____________________________。
②右图装置中,某一铜电极的质量减轻 3.2g ,则 a 极上消耗的O2在标准状况下的体积为 _____L。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。则正极附近的pH___________。(填“增大”、“减小”或“不变”)
24.(10分)(1)F2跟金属反应在金属表面形成一层致密性的金属氟化物的保护膜。(2分) (2)①:XeF2+2H2O=2Xe↑+O2↑+4HF(1分) ②:6XeF4+12H2O=4Xe↑+2O2↑+2XeO2+24HF(1分) (3)①:MnO4-(1分) 5XeO2+6Mn2++9H2O=5Xe↑+6MnO4-+18H+ 2XeO3=2Xe+3O2(或:4XeO3+4Mn2++6H2O=4Xe+4MnO4-+O2↑+12H+(1分) ②:0.18mol·L-1;7.0×10-4 mol·L-1(各2分,共4分)
70.(湛江二模)(10分)氟是一种氧化性极强的非金属元素,能强烈地与所有的金属反应,它甚至能与稀有气体氙反应生成XeF2、XeF4、XeF6等固体,这些固体都极易与水反应。其中XeF2与H2O仅发生氧化还原反应,而XeF4与H2O反应时,有一半的XeF4与H2O发生氧化还原反应,另一半则发生歧化反应: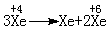 。XeF6则发生非氧化还原反应完全水解(已知:
。XeF6则发生非氧化还原反应完全水解(已知: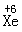 在水中主要以XeO3分子形式存在)。试回答下列问题:
在水中主要以XeO3分子形式存在)。试回答下列问题:
(1)
 在常温或不太高的温度下,可将氟盛装在铜、铁、镁、镍(或其它的合金)制成的容器中,原因是_____________________________________________________。
在常温或不太高的温度下,可将氟盛装在铜、铁、镁、镍(或其它的合金)制成的容器中,原因是_____________________________________________________。
(2) 完成下列反应的化学方程式:
① XeF2与H2O:___________________________________。
② XeF4与H2O:___________________________________。
(3)14.7gXeF4完全水解后,再加入100mL0.600mol·L-1Mn2+的水溶液,反应完全后,放出的气体干燥后再通过红热的金属铜,体积减少20%。
①通过计算可确定Mn2+的氧化产物为__________,相应的化学方程式为_______________,
②将所得溶液稀释到1000mL后,求溶液氢离子以及氟离子浓度。(已知弱酸HF在水溶液中存在电离平衡, ),溶液的c(H+)为_____,c(F-)为_____。
),溶液的c(H+)为_____,c(F-)为_____。
23.(13分) (1)B(2分) (2)HgBr2+CaO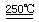 HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(2分) (3)①:SO2+O2+2H2O
HgO+CaBr2(1分) 循环过程需要很高的能量,且使用重金属汞,会产生污染。(2分) (3)①:SO2+O2+2H2O 2HI+H2SO4(1分) ②:2H2SO4
2HI+H2SO4(1分) ②:2H2SO4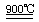 2SO2↑+O2↑+2H2O (1分) SO2和I2
可循环使用,无污染。(1分) (4)①<(1分) ②:加快;增大(2分) ③:Cu2O+CO
2SO2↑+O2↑+2H2O (1分) SO2和I2
可循环使用,无污染。(1分) (4)①<(1分) ②:加快;增大(2分) ③:Cu2O+CO Cu+CO2
(2分 不写可逆号扣1分)
Cu+CO2
(2分 不写可逆号扣1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com