
题目列表(包括答案和解析)
44.(汕头一模)下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是
A.Na+、Al3+、Cl-、OH- (5:1:4:4) B.NH4+、Ba2+、OH-、Cl- (1:1:1:2)
C.Fe3+、Na+、Cl-、S2- (1:2:3:1) D.K+、H+、I-、HCO3- ( 1:1:1:1)
42.(汕头一模)下列离子方程式正确的是
A.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O==SO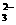 +2HClO
+2HClO
B.在硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO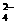 +Ba2++2OH–== BaSO4↓+2H2O
+Ba2++2OH–== BaSO4↓+2H2O
C.在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++2HCO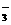 +Ca2++2OH–== MgCO3↓+CaCO3↓+2H2O
+Ca2++2OH–== MgCO3↓+CaCO3↓+2H2O
D.三氯化铝溶液中加入过量氨水:Al3++3OH– == Al(OH)3↓
.... 43.(汕头一模)钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O = 3 Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O = Fe3O4+4NaOH;
下列说法不正确的是
A.该生产过程会产生污染
B.反应②中的氧化剂是NaNO2
C.整个反应过程中每有16.8gFe参加反应转移0.8mol电子
D.反应①②③均是氧化还原反应
41.(汕头一模)在下列反应类型中,能体现绿色化学中的“原子经济”原则的是
(1)置换反应;(2)化合反应;(3)分解反应;(4)取代反应;(5)加成反应;(6)复分解反应;(7)酯化反应。
A.(2)(5)(7) B.(1)(2)(3)(4) C.(2)(5) D.(1)(2)(5)(6)
40.(东莞一模)金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是 ( )
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
39.(东莞一模)NO2-既有氧化性,又有还原性。NaNO2大量进入血液时,能将血红蛋白中的Fe2+氧化成Fe3+,正常的血红蛋白转化为高价铁血红蛋白,失去携氧功能,引起中毒,甚至死亡。下列各组试剂不能检验NO2-的是( )
A.FeCl2和KSCN B.AgNO3和HNO3
C.KMnO4和H2SO4 D.KI和淀粉
38.(东莞一模)下列说法或表示法正确的是( )
A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石);ΔH = +1.19 kJ· mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol-1
37.(东莞一模)下列各组离子在溶液中能大量共存,加入Fe2(SO4)3后仍能大量共存的是( )
A.Na+、I-、CO32-、ClO- B.Fe2+、H+、K+、NO3-
C.Ba2+、Na+、SCN-、Cl- D.Cu2+、Mg2+、Cl-、NO3-
36.(东莞一模)下列离子方程式书写正确的是( )
A.三氯化铝溶液中加人过量氨水 Al3++3OH- Al(OH)3↓
Al(OH)3↓
B.稀硝酸中加入过量的铁粉:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
C.4mol/L的NaAlO2溶液和7mol/L的HCI等体积互相均匀混合
4AlO2-+7H++H2O 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
D. 盐酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
35.(东莞一模)一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。
则下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
34.(东莞一模)有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是 ( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,SOCl2 被还原为Li2SO3
D.电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com