
题目列表(包括答案和解析)
26、(广东省茂名一模)(12分)辉钼矿(MoS2)是钼最重要的矿物。图26一l是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,… 是各炉层的温度(℃)。图26一2给出了各炉层的固体物料的摩尔百分组成。已知:MoS2焙烧生成1molMoO3的反应热为 △H1=一1011 KJ/mol, MoO2氧化生成lmolMoO3的反应热为△H2=一154KJ/mol。试回答:
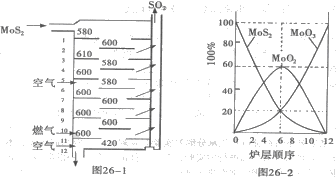
(l)辉铝矿焙烧生成MoO3的反应中被氧化的元素是: (填元素符号);指出辉钼矿焙烧生成的尾气对环境的一种危害:
(2)第6炉层存在的固体物质分别是: 它们的物质的量之比是:
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是:
(4)图26一2表明,中间炉层(4一6)可能存在一种“固体+固体、固体+ … ”的反应,请写出该反应的化学方程式:
(5)通过(3)和(4)你能解释为什么中间炉层(4一6)的炉温比上下炉层的炉温低吗?
26.(1)-33.42℃(1分), N2,H2(1分), (1分)
(2)增大氮气和氢气的浓度有利于增大反应速率(1分);减小氨气的浓度,增大氮气和氢气的浓度均有利于平衡向正反应方向移动(2分)
(3)N2(g)+3H2(g)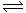 2NH3(g);△H= -92.4kJ/mol(2分)
2NH3(g);△H= -92.4kJ/mol(2分)
(4)AD(2分)
(5)N2+6 H++6e-=2NH3(2分)
26. (广东省梅州一模)(12分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)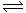 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
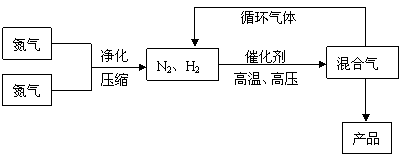
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 。写出该反应的化学平衡常数表达式:K= 。
(2)运用化学反应速率和化学平衡的观点说明工业上采取用上述实际生产措施的理由:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ ________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g)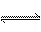 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
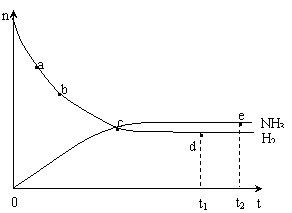 A.点a的正反应速率比点b的大
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
 D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
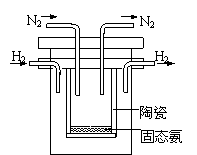
(5)1998年希腊亚里斯多德大学的Marmellos和Stoukides
采用高质子导电性的SCY陶瓷(能传递H+),实现了高温
常压下高转化率的电化学合成氨。其实验装置如图。
阴极的电极反应式 。
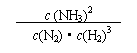
22.(1)黄铁矿为原料的生产中产生的废弃物太多,处理成本高(2分) (2)C、D(2分)
(3)①净化气体 ②控制温度在400-500℃ ③增大催化剂与反应气体的接触面积(3分)
(4)①<(1分),在1atm和298K条件下,2mol SO2和1mol O2完全反应生成2mol SO3,放出196kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为450℃,所以放出的热量小于196kJ (2分)
(5)93.4% (3分) (6) 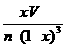 (2分)
(2分)
22.(广东省茂名二模)(15分)工业制硫酸生产流程如下图:
|
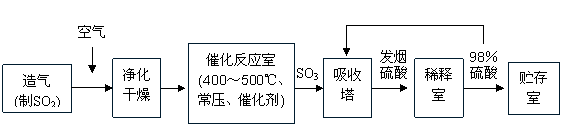

(1)早期生产用黄铁矿为原料,但现在工厂生产硫酸用硫磺为原料,理由是 (2分)
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 (2分)
A.升高温度 B.减少压强
C.不断补充SO2和空气 D.及时分离出SO3
(3)在生产中,为提高催化剂效率采取了哪些措施?
(3分)
(4)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是_______________________________________________________________________________。 (3分)
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是_______________________________________________________________________________。 (3分)
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为 (3分)
(6)在450℃、常压和钒催化条件下,在容积为VL的容器中加入2n molSO2和n molO2,反应达平衡后测得平衡常数为K,此时O2的转化率为x。则K和x的关系满足K= 。(2分)
25. (9分)(1)NH3 (1分)
② BC(只选1个且正确给1分,错选、多选不给分)(2分)
③c ;a(每空1分,共2分)
(2)④NH3 + H2O  NH3·H2O
NH3·H2O
 NH4+
+ OH- (2分)
NH4+
+ OH- (2分)
⑤ < (1分) ⑥ c(Cl-) > c(NH4+) > c(H+) > c(OH-) (1分)
25、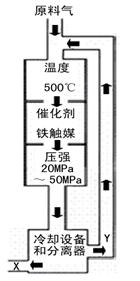 (佛山一模)(9分)
(佛山一模)(9分)
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的
原理是: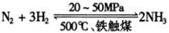 △H <0,生产流程如右图所示。
△H <0,生产流程如右图所示。
①X的化学式为 ;
②右图中条件选定的主要原因是(选填字母序号) ;
A.升高温度、增大压强均有利于氨的合成
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
 ③ 改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
③ 改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
④ 用方程式表示氨气溶于水且显弱碱性的过程:
;
⑤ 氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
⑥ 将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小
依次为 。
25.(10分)
(1)等于(2分); (2)90%(2分); (3)大于(2分); (4)1.7a(2分);将活塞向左推 (2分)
25.(广东省韶关市一模)(10分)如图所示,当关闭K时,向A中充入4molX、14molY,向B中充入2molX、7molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)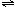 Z(g)+2W(g);△H<0。达到平衡(Ⅰ)时,B中密度变为原来的
Z(g)+2W(g);△H<0。达到平衡(Ⅰ)时,B中密度变为原来的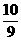 ,试回答:
,试回答:
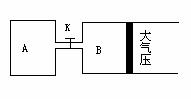 (1)设A、B两容器中化学平衡常数分别为K1和K2,则它们的大小关系是K1____K2(填“大于”或“等于”或“小于”)。
(1)设A、B两容器中化学平衡常数分别为K1和K2,则它们的大小关系是K1____K2(填“大于”或“等于”或“小于”)。
(2)B中X的转化率α(X)B为 ____________ 。
(3)A中Z和B中的W物质的量的比较:n(Z)A n(W)B (填“大于”或“等于”或“小于”)。
(4)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 _______ 升(用含a的代数式表示,连通管中气体体积不计);在温度不变的情况下,要使B容器恢复原来反应前的体积,可采取的措施是 。
26.(12分)
(1)Zn2++ 4OH-==[Zn(OH)4]2-(2分);
(2)10-17(2分); (3)(8.0,12.0)(2分); (4)1.80(3分,写1.8得2分);
(5)A B C D (3分,写对1个得0分,写对2个得1分,写对3个得2分,漏1个扣1分,扣完为止)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com