
题目列表(包括答案和解析)
7.(08上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
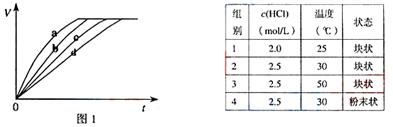
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
解析:化学反应速率与温度、浓度和固体物质的表面积的大小有关,实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3虽然浓度相同,但反应的温度不同,物质的状态也不相同,所以不能比较。
答案:A、C
6.(08四川卷)在密闭的容器中进行如下的反应:H2(G+I2(g)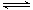 2HI(g),在温度T1和T2时,产物的量彧时间的关系如下图所示,符合图象的正确的判断是( )
2HI(g),在温度T1和T2时,产物的量彧时间的关系如下图所示,符合图象的正确的判断是( )
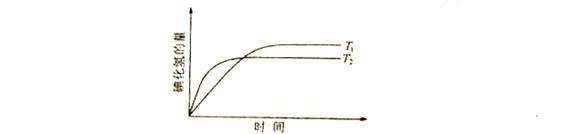
A.T1>T2,△H>0 B.T1>T2,△H<0
C.T1<T2,△H>0 D.T1<T2,△H<0
解析:根据“先拐现平数字大”的原则,从图可以看出,反应时的温度T2>T1,且温度越高,HI的量越少,说明升高温度,平衡向逆反应方向移动,即该反应的正反应属于放热反应,△H<0。
答案:D。
5.(08北京卷)工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
[解析]该反应为体积增大的反应,增大压强平衡左移,减小SiCl4转化率,A错;该反应为可逆反应,不能实现完全转化,放出的热量一定小于QkJ,B错;反应至4min时,HCl的浓度为0.12mol/L,表示的反应速率为:v(HCl)=0.03mol/L.min,换算为v(H2)=0.015mol/L.min,C错;当放热0.025QkJ时,说明反应的SiCl4为0.025mol,生成HCl 0.1mol,其与100mL1mol/L的NaOH恰好反应,D正确。
[答案]D
[高考考点]化学平衡的移动、反应热、反应速率知识
[易错提醒]不能正确理解反应热的意义,造成错误解答。
[备考提示]对于反应热的知识,关键要理解化学反应过程中热量变化的原因是反应物总能量和和生成物总能量不相等。特别是在可逆反应中,反应热仍然是指物质完全反应时的数值。
4.(08天津卷)对平衡CO2(g)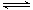 CO2(aq);△H=
-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
CO2(aq);△H=
-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
A.升温增压 B.降温减压
C.升温减压 D.降温增压
解析:气体在水中的溶解度随着温度的升高而降低,所以要使CO2在水中的溶解度增大,可以降低温度,同时还可增大压强。
答案:D。
3.(08广东卷)对于反应2SO2(g)+O2(g)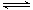 2SO3(g),能增大正反应速率的措施是(
)
2SO3(g),能增大正反应速率的措施是(
)
A.通入大量O2 B.增大窗口容积
C.移去部分SO3 D.降低体系温度
解析:增大反应物的浓度,正反应速率加快,在此瞬间逆反应速率不变。
答案:A
2.(08全国Ⅱ卷)在相同温度和压强下,对反应CO2(g)+H2(g)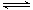 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
 |
CO2 |
H2 |
CO |
H2O |
|
甲 |
amol |
amol |
0mol |
0mol |
|
乙 |
2amol |
amol |
0mol |
0mol |
|
丙 |
0mol |
0mol |
amol |
amol |
|
丁 |
amol |
0mol |
amol |
amol |
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
解析:
CO2(g)+H2(g)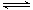 CO(g)+H2O(g)
CO(g)+H2O(g)
甲: amol amol 0mol 0mol
乙: 2amol amol 0mol 0mol
等效后的丙: amol amol 0mol 0mol
等效后的丁: 2amol amol 0mol 0mol
答案:A。
1.(08海南卷)X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
解析:由可知:
X+2Y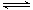 2Z
2Z
起始: 1 1 0
转化: a 2a 2a
平衡: 1-a 1-2a 2a
根据题意有: = ,a=,Y的转化率最接近65%。
答案:D。
30、(08上海卷)(B)元素A-D是元素周期表中短周期的四种元素,请根据表中的信息回答下列问题。

(1)上表中与A属于同一周期的元素是_____________,写出D离子的电子排布式______________________。
(2)D和C形成的化合物属于_________晶体。写出C单质与水反应的化学方程式_________________________。
(3)对元素B的单质或化合物描述正确的是_________。
a、B元素的最高正价为+6 b、常温、常压下单质难溶于水
c、单质分子中含有18个电子 d、在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是(写元素符号)_____。写出能证明该结论的一个实验事实________________。
答案:(B)(1)Mg;1s22s22s6。
(2)离子;2F2+2H2O 4HF+O2.
4HF+O2.
(3)b;d(B是氧气或氮气)。
(4)Na;钠与水反应比镁与水反应激烈或氢氧化钠的碱性比氢氧化镁强。
2008高考化学分类解析7-化学反应速率和化学平衡
29.(08上海卷)(A)四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题:

(1)B元素在周期表中的位置是_________________________,写出A原子的电子排布式__________________。
(2)写出C单质与水反应的化学方程式____________________________________________。A与C形成的化合物溶于水后,溶液的pH__________7(填“大于”、“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度________(填“大”、“小”),其理由是____________________________。
(4)A、B两元素非金属性较强的是(写元素符号)__________。写出能证明这一结论的一个实验事实_____________________________________________________。
答案:(A)(1)第三周期;ⅦA;1s22s22p63s23p6。
(2)2Na+2H2O 2NaOH+H2↑;大于。
2NaOH+H2↑;大于。
(3)大;SiO2是原子晶体 或 小 CO2是分子晶体。
(4)Cl;高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强。
28.(08海南卷)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数
依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_____、_______; 杂化轨道分别是________、_________;a分子的立体结构是____________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体:
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________;
(4)Y与Z比较,电负性较大的____________, 其+2价离子的核外电子排布式是_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com