
题目列表(包括答案和解析)
5.pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如下图所示,下列说法不正确的是
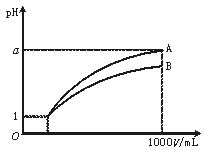
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
4.在25℃时,某溶液中由水电离出的c(H+)=1×10-12 mol·L-1,则该溶液的pH可能是
A.12 B.7 C.6 D.2
3.25 ℃时,pH=2的盐酸中,由水电离出的c(H+)是
A.1×10-7 mol·L-1 B.1×10-12 mol·L-1
C.1×10-2 mol·L-1 D.1×10-14 mol·L-1
2.向纯水中加少量的硫酸氢钠(溶液温度不变)则溶液的
A.pH升高 B.酸性增强
C.KW增大 D.c(OH-)减少
1.(2001年上海高考题)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg ,则下列叙述正确的是
,则下列叙述正确的是
A.中性溶液的AG=0
B.酸性溶液的AG<0
C.常温下0.1 mol·L-1氢氧化钠溶液的AG=12
D.常温下0.1 mol·L-1盐酸溶液的AG=12
15.(6分)已知(1)Cu2+、Fe2+在pH为 4-5的条件下不水解,而这一条件下Fe3+几乎全部水解。
(2)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。
现用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液的过程如下:
①取50 mL纯净的盐酸,加入一定量的粗CuO加热搅拌、充分反应后过滤,测知滤液的pH=3。
②向滤液中加入双氧水、搅拌。
③调节②中溶液的pH至4,过滤。
④把③所得滤液浓缩。
回答以下问题:
(1)②中发生反应的离子方程式是 。
(2)③中使pH升高到4,采取的措施是:加入过量的 并微热、搅拌。
A.NaOH B.氨水
C.CuCl2 D.CuO
(3)③中过滤后滤渣的成分是 。
14.(6分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液的等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液的等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 。
(2)c(H2A)最大的是 ,最小的是 。
(3)c(A2-)最大的是 ,最小的是 。
13.(9分)某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银,步骤如下:
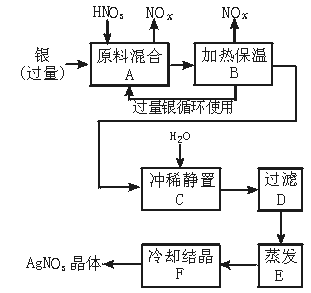
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填“浓”或“稀”),原因是 。
a.减少过程中产生NOx的量
b.减少原料银的消耗量
c.节省硝酸物质的量
(2)步骤B加热保温的作用是 。
a.有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中c(H+)
(3)步骤C是为了除去Fe3+、Cu2+等杂质。冲稀静置时发生的化学反应是 。
a.置换反应
b.水解反应
c.氧化还原反应
产生的沉淀物化学式是 。
12.(10分)25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
(5) 和 两种粒子物质的量之和比氢离子数量多0.008 mol。
11.(12分)用离子方程式表示下列反应:
(1)某可溶性盐的化学式XmYn(是最简结构m≠n),将一定量的该盐溶于足量的水中,若测得溶液的pH为3,该盐水解的离子方程式可能为 。若测得溶液的pH为11,则该盐与水反应的离子方程式可能为 。
(2)NH4Cl溶液与Na反应 。
(3)AlCl3溶液与NaAlO2溶液反应 。
(4)CuSO4溶液与Na2S溶液反应 。
(5)NaHSO4溶液与NaHCO3溶液反应 。
(6)FeCl3溶液与NaI溶液反应 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com