
题目列表(包括答案和解析)
9、(04上海卷-7)实验室制取下列气体,其反应放热的是( )
A.由无水醋酸钠制CH4 B.由乙醇制C2H4 C.由电石制C2H2 D.由氯酸钾制O2
8、(04广东卷-17)已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g水时放出的热量是( )
A、26.0kJ B、51.9kJ C、155.8kJ D、467.3kJ
7、(04全国卷Ⅱ-13)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨) + O2(g) === CO2(g) △H = -393.51kJ ·mol-1
C(金刚石) + O2(g) === CO2(g) △H = -395.41kJ ·mol-1
据此判断,下列说法中正确的是 ( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
6、(04全国卷Ⅲ-8)已知:(l)H2(g) +0.5O2(g) =H2O(g);△H1=a kJ·
(2)2H2(g) +O2(g) =2H2O(g);△H2=b kJ·
(3)H2(g) +0.5O2(g)=H2O(l);△H3=c kJ·
(4)2H2(g) +O2(g) =2H2O(l); △H4=d kJ·
下列关系式中正确的是
A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
5、(04全国卷Ⅳ-12)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+1.5O2(g) CO2(g)+2H2O(l); △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l); △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l); △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l); △H=+1452 kJ/mol
4、(03全国新课程卷-13)已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g); ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l); ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g); ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g); ΔH=+484kJ·mol-1
3、(03江苏卷-4)已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( )
A. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g); △H=-48.40kJ·mol-1
B. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
2、(2002年天津卷-9)沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是
A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);ΔH=+890kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l); ΔH=+890kJ·mol-1
C. CH4(g)+4O2(g)=CO2(g)+2H2O(l); ΔH=-890kJ·mol-1
D. 1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l); ΔH=-890kJ·mol-1
1、(2000年山西卷-14)今有如下3个热化学方程式:
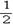 H2(g)+ O2(g)=H2O(g) ΔH=a KJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=a KJ·mol-1
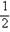 H2(g)+ O2(g)=H2O(l) ΔH=b KJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=b KJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=c KJ·mol-1
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值 C.a=b D.2b=c
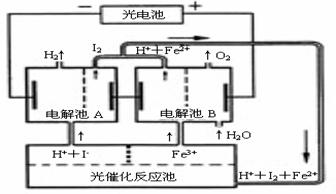
42.(2006年江苏卷(10分))利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com