
题目列表(包括答案和解析)
13.(08北京卷)下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
[解析]①中KOH和AlCl3互滴现象不同,另一种是Na2SO4,可以鉴别;②中H2SO4和NaHCO3生成气体,和Ba(OH)2生成白色沉淀,可以鉴别;③中HCl和NaHSO4与NaAlO2反应的现象不同,不能鉴别;④中Ca(OH)2和BaCl2与Na2CO3反应现象相同,不能鉴别。 [答案]A[高考考点]常见元素化合物的性质,物质的检验知识
[易错提醒]不能理解滴加顺序不同,现象不同,错误判断①
[备考提示]此题考查了常见物质在溶液中的反应,解答此类题目要求学生熟练掌握常见的化学反应,特别是一些特殊的反应,例如反应物比例不同对产物有影响的反应,如铝盐与强碱的反应,碳酸钠和盐酸的反应等。
12.(08天津卷)下列离方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4++HSO3-+2OH- NH3Ÿ+SO32-+2H2O
NH3Ÿ+SO32-+2H2O
C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:
IO3-+5I-+3H2O=3I2+6OH-
D.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+
解析:选项A中Ca(OH)2为微溶性物质,所以石灰乳的化学式不能改写;选项C中在酸性溶液中OH-与H+不能共存;选项D中的AgOH要进一步与NH3·H2O反应。答案:B。
11.(08广东卷)下列反应的离子方程式正确的是( )
A.钠与水的反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe++Cu=Fe2++Cu2+
解析:选项A中此反应的电子不守恒,方程式两边的H原子个数也不相等;选项B中Cl2+H2O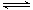 HCl+HClO,由于HClO为弱酸,所以在离子方程式中不能改写;选项D中离子方程式中的电荷不守恒,得失电子也不守恒。答案:C
HCl+HClO,由于HClO为弱酸,所以在离子方程式中不能改写;选项D中离子方程式中的电荷不守恒,得失电子也不守恒。答案:C
10.(08广东卷)下列各组离子一定能大量共存的是( )
A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO32-、NO3-
C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO3-
解析:选项A中(AlOH4)-与H+不能共存;选项C中pH=12,则c(OH-)=0.01mol·L-1,NH4+与OH-不能共存;选项D中溶液呈酸性,NO3-在酸性溶液中具有强氧化性,与具有还原性的I-不能共存。答案:B
9.(08重庆卷)下列各组离子在给琮条件下能大量共存的是( )
A.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B.有SO2-4存在的溶液中:Na+ 、Mg2+、Ca2+、I-
C.有NO-3存在的强酸性溶液中:NH+4、Ba2+、Fe2+、Br-
D.在c(H+)=1.0×10-13mol·L-1的溶液中:Na+、S2-、AlO-2、SO2-3
解析:选项A中,溶液呈强酸性,溶液中的Cl-+ClO-+2H+===Cl2↑+H2O;选项B中Ca2++SO42- ===CaSO4↓;选项C中在酸性溶液中NO3-具有强氧化性,与Fe2+、Br-不能共存;选项D中溶液呈强碱性,这几种离子均能共存。答案:D。
8.(08江苏卷)下列离子方程式正确的是( )
A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+
 H2↑+ Cl2↑
H2↑+ Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+ + 2OH-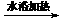 CH3COO- + NH4+
+3NH3 + 2Ag↓+ H2O
CH3COO- + NH4+
+3NH3 + 2Ag↓+ H2O
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH
+ 2CO32-
2C6H5OH
+ 2CO32-
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- == 5SO42- + 2Mn2+ 3H2O
解析:选项A中水为弱电解质,书写离子方程式时不能改写;选项C中正确的离子方程式为: -O-+CO2+H2O
-O-+CO2+H2O
 -OH+HCO3-。答案:B、D。
-OH+HCO3-。答案:B、D。
7.(08江苏卷)在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
解析:选项A中使酚酞溶液呈红色,则溶液必定呈碱性,则OH-与Fe3+不能共存;选项B中使紫色的石蕊试液变红的溶液呈酸性,NO3-在酸性溶液中具有强氧化性与Fe2+不能共存;选项C中c(H+)=10-12 mol·L-1的溶液呈碱性,在碱性溶液中,这些离子均能共存;选项D中HCO3-与H+不能共存。答案:C。
6.(08江苏卷)下列文字表述与反应方程式对应且正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯: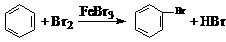
解析:选项A中要检验溴乙烷中的溴原子,必须先将溴乙烷在NaOH溶液中水解,然后用过量的HNO3综合NaOH溶液,再加入AgNO3。选项B中CH3COOH为弱酸,在离子方程式中不能改写;选项C中离子方程式的得失电子不守恒和电荷不守恒。答案:D。
5.(08广东卷)下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH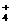 +HCO
+HCO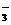
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3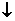 +2HClO
+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO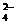 =CaSO4
=CaSO4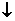 +H2O
+H2O
解析:HClO有强氧化性,可把SO32-氧化为SO42-,B错。稀HNO3有氧化性,可把S2-与Fe2+氧化,应为FeS+4HNO3=Fe(NO3)3+S↓+NO+H20(还有可能生成SO2,SO3) C错。D应为Ca2++ 2OH- +2H+ + SO42- ==CaSO4↓ + 2H2O,所以D错。答案:A
4.(08全国Ⅰ卷)在溶液中加入中量Na2O2后仍能大量共存的离子组是( )
A.NH+4、Ba2+、Cl-、NO-3 B.K+、AlO-2、Cl-、SO2-4
C.Ca2+、Mg2+、NO-3、HCO-3 D.Na+、Cl-、CO2-3、SO2-3
解析:此题主要从两方面考虑:一是考虑Na2O2的氧化性,溶液中具有还原性的离子不能共存,如选项D中的SO32-;二是2Na2O2+2H2O===4NaOH+O2↑,考虑不能与OH-共存的离子,如选项A中的NH4+,选项C中的Mg2+、Ca2+、HCO3-。答案:B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com