
题目列表(包括答案和解析)
12.(5分)按要求填写下列空白。
(1)化合价主要决定于 。
(2)同位素主要决定于 。
(3)质量数决定于 。
(4)原子序数决定于 。
(5)元素的化学性质主要决定于 。
11.(3分)在一定条件下RO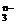 和I-发生反应的离子方程式如下:RO
和I-发生反应的离子方程式如下:RO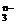 +6I-+6H+===R-+3I2+3H2O
+6I-+6H+===R-+3I2+3H2O
(1)RO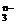 中R元素的化合价是
,n=
。
中R元素的化合价是
,n=
。
(2)R元素的最外层电子数是 。
10.(8分)(2002年全国高考理综题)已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。②X在A、B、C、D中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解。可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
9.有关叙述:(1)非金属单质M能从N的化合物中置换出非金属单质N。(2)M原子比N原子容易得到电子。(3)单质M跟H2反应比N跟H2反应容易得多。(4)气态氢化物水溶液的酸性HmM>HnN。(5)氧化物水化物的酸性HmMOx>HnNOy。(6)熔点M>N。能说明M比N的非金属性强的叙述是
A.①②③ B.②③⑤
C.①②④⑤ D.全部
8.X,Y,Z,W均为短周期元素,它们在周期表中位置如图所示。若Y原子的最外层电子数是内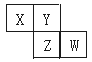 层电子数的3倍,下列说法中正确的是
层电子数的3倍,下列说法中正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化合的酸性:Z>W>X
C.相等物质的量浓度气态氢化物溶液的pH:X>Z>W
D.四种元素的单质中,X单质的熔、沸点最高
7.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数
A.只有x+1
B.可能是x+8或x+18
C.可能是x+2
D.可能是x+1或x+11或x+25
6.两种短周期元素的化合物中,原子个数比为1∶3,若两种元素的原子序数分别为a和b,则a和b的关系可能是
①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8
A.①②③④ B.只有②③④
C.只有②③ D.只有③④
5.已知氢化锂(LiH)属于离子晶体,LiH跟水反应可以放出氢气,下列叙述中正确的是
A.LiH的水溶液显中性
B.LiH中的氢离子可以被还原成氢气
C.LiH是一种强氧化剂
D.LiH中氢离子半径比锂离子的半径大
4.同主族元素所形成的同一类化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中错误的是
A.它是共价化合物
B.在加热时,它能分解
C.它能跟碱发生反应
D.它可由PH3和HI化合而成
3.运用元素周期律分析下列推断,其中错误的是
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体、HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒比H2S稳定的气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com