
题目列表(包括答案和解析)
7.(8分)
为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
⑴图一可通过观察
定性比较得出结论。
有同学提出将CuSO4改为CuCl2更为合理,其理由是: ,你认为还可以作何改进? 。

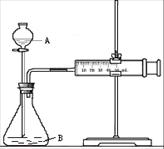
图一 图二
⑵检查图二装置气密性的方法是
。
图二所示实验中需测量的数据是 。
6.(7分)茶是东南亚各国人民喜爱的饮品,各种茶叶品种中安溪铁观音最负盛名。茶叶中含有多种有益于人体健康的有机成分与多种微量元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500克干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6-7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL。请回答下列问题
步骤 1中,使茶叶灰化需要三角架、泥三角、酒精喷灯、 、坩埚钳等仪器。
步骤2中,改用试剂________________来调节pH将更为方便;判断沉淀已经洗涤干净的方法是 。
步骤3中,滴定操作时,眼睛注视 。被滴定的20 mL滤液中 CO32-的物质的量为______________mol,原茶叶中钙离子的质量分数为__________________。
5.(8分)为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:

(甲) (乙) (丙)
(1)请写出CO2与过量的NaOH发生反应的离子方程式:
___ _____。
(2)选择任意一种实验装置,简述预计出现的实验现象,解释产生该实验现象
的原因: 你选择的实验装置是 ,实验现象是 ____ ____。
解释产生该实验现象的原因: ________。
4.(15分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯气的性质。
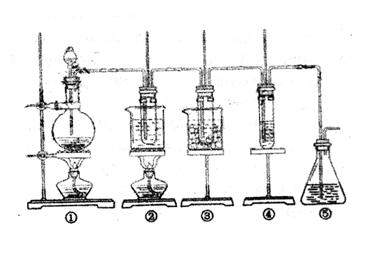
图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛典有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有氯化亚铁溶液⑤为尾气吸收装置。
请填空下列空白:
(1)制取氯气时,在烧瓶里加一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,才者的差异是:
。
(3)本实验中制取氯酸钾的离子方程工是 。
(4)实验中可观察到④的试管里溶液的颜色从浅绿色逐渐变为 色,其原因是 ( 用离子方程式解释)。为了检验生成的物质,可加入 。
3.(共4分) 某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是_________________。
2、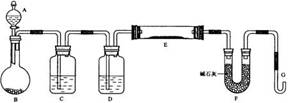 (12分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
(12分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题。
(1)仪器中装入的试剂:
B 、 C 、
D ;
(2)连接好装置后应首先 ,
其方法是
;
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 。在这两步之间还应进行的操作是 ;
(4)反应过程中G管逸出的气体是_______,其处理方法是__________________。
(5)从实验中测得了下列数据:
①空E管的质量a ②E管和WO3的总质量b ③反应后E管和W粉的总质量c(冷却到室温称量) ④反应前F管及内盛物的总质量d ⑤反应后F管及内盛物的总质量e 由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):Ar(W)= 。
2.[猜想II]:主要成分为氯化锌;
[验证(操作)过程]: ;
[实验现象]: ;
[判断猜想]:猜想Ⅱ成立;由上述实验得出结论:滤液中的主、次成分: 。
1.[猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]: (填“猜想I成立”或“猜想I不成立”);
1.(14分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
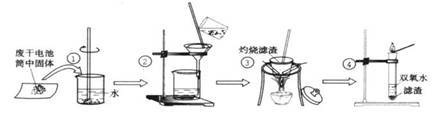
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 ;
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,试管中发生反应的化学方程式: ;
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为: 。
(4)已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
23.(23分)实验室模拟合成氨和氨催化氧化的流程如下:
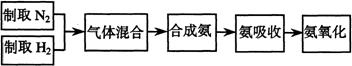
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和
氯化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:
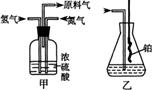 氮气
(2分)、氢气
(2分)
氮气
(2分)、氢气
(2分)
(2)氮气和氢气通过甲装置,甲装置的作用除了将气
体混合外,还有 (2分)、
(2分)
(3)氨合成器出来经冷却的气体连续通人乙装置的
水中吸收氨, (2分)(“会”或
“不会”)发生倒吸,原因是:
(2分)。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: (2分),锥形瓶中还可观察到的现象是: 。(2分)
(5)写出乙装置中氨氧化的化学方程式: (3分)
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。(各2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com