
题目列表(包括答案和解析)
8.(1)n(NaClO)︰n(NaClO3)=1︰2 (2)7Cl2+14NaOH=NaClO+2NaClO3+11NaCl+7H2O (3)c(NaClO)=0.2mol/L c(NaClO3)=0.4moL/L c(NaCl)=2.2mol/L
8.将15.68L(标准状况)的氯气通入70℃、500mL氢氧化钠溶液中,氯气发生了两个自身氧化还原反应,其氧化产物分别为次氯酸钠和氯酸钠。若取此溶液25.00mL。稀释到250.0mL。再量取此稀溶液25.00mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾。用浓度为0.2000mol/L硫代硫酸钠溶液滴定生成的碘:I2+2S2O32-=2I-+S4O62-,消耗硫代硫酸钠溶液5.00mL时恰好到终点。将滴定后的溶液再用盐酸酸化至强酸性,此时氯酸钠亦能氧化碘化钾,生成的碘再用上述硫代硫酸钠溶液滴定到终点,需要硫代硫酸钠溶液30.00mL。
(1)计算氯气反应后的溶液中次氯酸钠和氯酸钠的物质的量之比。
(2)写出符合上述条件的总化学方程式。
(3)若氢氧化钠溶液在通入氯气前后的体积变化可忽略不计,计算通入氯气后各生成物的物质的量浓度。
7.4NxHy+yO2 →2xN2+2yH2O 反应前后质量守恒,同温同压下气体密度与气体体积成反比 x=2,y=4 N2H4
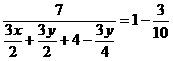
7.在120℃,1.01×105Pa时,将4mLO2和3mLNxHy(y>x)混合气体充入一密闭与容积可变的容器中,点燃充分反应,恢复到原温度和压强,测得容器中N2、O2、H2O混合气体密度减小3/10。
(1)试写出该反应的化学方程式为 。
(2)通过计算推断NxHy的分子式:
6.(1)50:1 (2)c(H2SO4) = 1.25 mol·L-1 (3)2.436g
6.某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识,并对感兴趣的问题进行探讨。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
(1)计算此钢样粉末中铁和碳的物质的量之比。
(2)再取三份不同质量的钢样粉末分别加到100mL相同浓度的稀H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
(3)若在实验Ⅱ中继续加入3.812g钢样粉末,计算反应结束后剩余的固体质量为多少?
5.(1)CaCO3·MgCO3 (2)0.5mol/LNa2CO3,1mol/LNaHCO3
5.我省蕴藏着丰富的白云石,其化学式是xCaCO3·yMgCO3。以它为原料可以制取多种物质,如耐火材料等。现取27.6g白云石,加热到质量不再变化,收集到的CO2为6.72L(已换算成标准状况)
(1)试通过计算确定白云石的化学式(取x、y的最小整数比)。
(2)将产生的二氧化碳气体用200mL 2mol/L的NaOH溶液吸收,若不考虑溶液的体积变体,试通过计算分析,吸收后所得溶液的溶质名称以及溶液的物质的量浓度。
4、(1)1:2 (1分) 0.5 (1分)
(2)3.5 (2分)
(3)0<x<0.2 (2分), y=5-15x (2分)
4、(8分)现有一种铜粉与氧化铜粉末的混合物:
(1)经测定该混合物中铜元素与氧元素的质量之比为6:1,则混合物中铜粉与氧化铜的物质的量之比为 ;112g上述混合物在加热条件下与足量的浓硫酸充分反应后,产生SO2的物质的量为 mol;
(2)若铜粉与氧化铜粉末的混合物中氧元素的质量分数为0.1,则160g该混合物在加热条件下与足量的浓硫酸反应,消耗硫酸的物质的量为 mol;
(3)设混合粉末中氧元素的质量分数为x,160g该混合物与足量的浓硫
酸反应,消耗硫酸的物质的量为y mol,写出x的取值范
围 ,及y与x之间的关系
式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com