
题目列表(包括答案和解析)
8.在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:
2NO2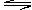 N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
A.x>y B.x<y C.x=y D.不能确定
7.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A 可用铁作阳极材料 B 电解过程中阳极附近溶液的pH升高
C 阳极反应方程式为:2Cl--2e-=Cl2
D 1mol二价镍全部转化为三价镍时,外电路中通过1mol电子
6.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
A.①② B.①③ C.①④ D.③④
5.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为:
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
4. 0.02mol·L-1的HCN溶液与0.02mol·L-1NaCN溶液等体积混合,已知混合溶液中c(CN-)﹤c(Na+),则下列关系中,正确的是
A、c(Na+)﹥c(CN-)﹥(OH-)﹥c(H+) B、c(HCN)+c(CN-)=0.04mol·L-1
C、c(Na+)+c(H+)=c(CN-)+c(OH-) D、c(CN-)﹥c(HCN)
3.恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b- )
)
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.当v正(A)=2v逆(B)时,可确定反应达平衡
2. 容积固定的2L密闭容器中进行的某一可逆反应
容积固定的2L密闭容器中进行的某一可逆反应
A(g)+2B(g) 2C(g),以B的物质的量浓度改变表示的反应
2C(g),以B的物质的量浓度改变表示的反应
速度v(正),v(逆)与时间的关系图如所示。已知反应速率v的
单位为mol·L-1·s-1,则图中阴影部分的面积可表示
A.A的物质的量浓度的减少 B.B的物质的量浓度的减少
C.C的物质的量增加 D.B的物质的量减少
1.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是
A.HF、HCI、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次减低
C.F2、C12、Br2、I2的熔、沸点逐渐升高
D.H2S的熔沸点小于H2O的熔、沸点
10. 石墨能与熔融金属钾作用,形成石墨间隙化合物,
石墨能与熔融金属钾作用,形成石墨间隙化合物,
K原子填充在石墨各层面料原子中。比较常见的
石墨间隙化合物是青铜色的化合物,其化学式可
写作CxK,其平面图形见右图,则x值为
A.8 B.12 C.24 D.6
本资料由《七彩教育网》 提供!
9. 0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com