
题目列表(包括答案和解析)
3.(8分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件
已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化
合物D是重要的工业原料。

(1)写出A在加热条件下与H2反应的化学方程式
_________________________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式_______________________
(3)写出一个由D生成B的化学方程式_______________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
2.(14分)A-I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
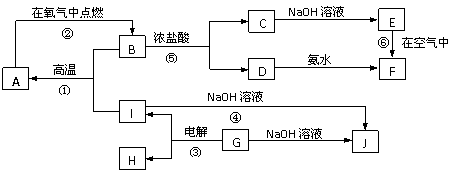
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置 。
⑵写出C、G物质的化学式:C ;G 。
⑶写出下列反应的化学方程式或离子方程式:
反应①的化学反应方程式: ;
反应④的离子方程式: ;
反应⑥的化学反应方程式: 。
⑷从能量变化的角度看,反应①、②、③中,属于△H<0的反应是 (填序号)。
1.(15分)V、W、X、Y、Z是由周期表中1-20号部分元素组成的5倍化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:

(1)5种化合物分别是V 、W 、X 、Y 、Z :(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 :
(3)V的电子式是 。
28.(1)铁、阴极,Ag+ + e- = Ag;银、阳极,Ag – e- = Ag+,AgNO3
(2)红,蓝
(3)4480
(4)Fe电极和Cu电极中间(2分),Cu + 2H2O  Cu(OH)2 + H2↑(3分)
Cu(OH)2 + H2↑(3分)
本资料由《七彩教育网》 提供!
28.下图为相互串联的甲、乙两个电解池。

试回答:
(1)若甲池利用电解原理在铁上镀银,则A是______________、________________(依次填电极材料和电极名称),电极反应是_____________________________________;B是_________________、_____________________(依次填电极材料和电极名称),电极反应是_________________________;应选用的电解质溶液是_________________________。
(2)乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈______________色,铜极附近呈______________色。
(3)若甲池阴极增重43.2g且乙池中阴极上一直都有气体产生,则乙池中阴极上放出的气体在标准状况下的体积是___________________mL。
(4)乙池中_____________________________最先出现浑浊,其电解的反应方程式为____________________________________________。
27.
(1)材料是___ Cu _____;Y是____AgNO3___ ____;
(2)_____正___极,电极反应为____Ag++e-=Ag__________________________;
X电极反应为_______Cu-2 e =Cu2+__ ___________________;
(3)速率是 0.025mol/L.min 。
(4)原因 不能,该反应不能自发进行
27.依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。


请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)当Ag+的消耗速率为0.05mol/(L·min)时,Cu2+的生成速率是 。
(4)铜与盐酸的反应可用于设计原电池吗?简述原因。
26、(1)① 碳(C );铁(Fe) ② 4 OH--4 e-=== 2H2O + O2↑
(2)①2 Cl-+2H2O 2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
②5Cl2 + I2 + 6H2O === 10HCl + 2HIO3
③13
26、甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则此时溶液的pH= 。(不考虑电解产物的相互反应)
25、(广东卷5)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是C
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com