
题目列表(包括答案和解析)
29. 标准状况下,a L Cl2通入到1 L b mol/L的FeI2溶液中,充分反应后,所得溶液中Fe2+的物质的量浓度与a、b的关系如下表,请完成其余空格。
|
a、b的关系 |
Fe2+的物质的量浓度(mol/L) |
|
a≤22.4b |
① b |
|
② a≥33.6b |
0 |
|
22.4b≤a≤33.6b |
③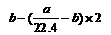 |
C.等于2 D.大于1/2
28、(8分,每空2分)⑴PbO2>KMnO4>H2O2
⑵紫红色褪去,生成白色沉淀
⑶②2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H
③5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
28、(8分)根据下列事实完成下列反应方程式:
(1)AsH3是一种很强的还原剂。室温下,它能在空气中自燃,其氧化产物为As2O3,写出反应的化学方程式: 。
(2)白磷在一定条件下可被HClO3的水溶液氧化,生成磷的最高价态化合物,而氯元素被还原为最低价态,写出反应化学方程式 。
(3)稀硫酸与铜不反应,但在稀硫酸中加H2O2后,则可使铜顺利溶解,写出该反应的离子方程式: 。
(4)在火箭推进器中装有强还原剂(N2H4)和强氧化剂H2O2。当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量。写出此反应的热化学方程式:
。
27、(1)3.5 1:1
(2)Fe2O42-+Cu2O+10H+=2 Fe2++2 Cu2++5H2O 4分
27.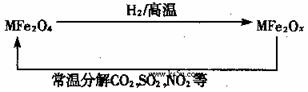 (8分)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(8分)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2︰1,则还原产物MFe2Ox中x= ,MFe2Ox中+2价铁与+3价铁的量之比为 。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+: Fe2O42-+2e-+8H+→2Fe2++4H2O
有KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离于方程式并配平 。
26.11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是B A.2/5 mol B.1/5 mol C.11/5 mol D.1/3 mol
25.一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)===NH4I+At NH2
下列叙述正确的是B
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D.AtI与液氨的反应中,得失电子数相等
24.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中氧化剂与还原剂的物质的量之比为B
A.1:10 B.1:11 C.1:12 D.1:13
23.取相同体积的KI、Na2S和FeBr2溶液分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温同压下),则KI、Na2S、FeBr2溶液的物质的量浓度之比为C
A.1︰1︰2 B.2︰1︰3 C.6︰3︰2 D.3︰2︰1
22.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2+ + 2S2O32- + O2 + xOH-=Fe3O4 + S4O62- + 2H2O。下列说法正确的是B
A.硫元素被氧化,铁元素被还原
B.Fe2+、S2O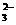 都是还原剂
都是还原剂
C.每生成1mol Fe3O4,转移电子数为3mol D.x=2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com