
题目列表(包括答案和解析)
(一)硫及其重要化合物间的相互转化关系(见上图)
注意:
1、氧化性酸与酸的氧化性的区别
酸根部分易得电子--有氧化性--氧化性酸
酸的氧化性应包括H+的氧化性(酸所共有的)与酸根的氧化性(氧化性酸的特点)两种类型
2、根据氯气、硫等非金属单质性质的学习,掌握非金属单质性质的一般方法应从下列几个方面分析:
与氢气的反应;与金属的反应;与氧气的反应;与非金属的反应;与水的反应;与氧化物的反应;与碱的反应;与酸的反应;与盐的反应;(与有机物反应)等。
3、掌握化合物性质的一般方法应从下列几个方面分析:
稳定性;可燃性;酸碱性;氧化性和还原性;特殊性等。
3.例题精讲
[例1]哪些实验事实说明氯元素的非金属性比硫元素强,并用原子结构知识加以解释。
解析:目前,已学习过多种非金属元素,通过卤族、氧族元素的学习可得出,比较两种非金属元素的非金属性相对强弱一般可根据以下几方面的实验事实:①非金属单质与H2化合的难易以及氢化物的稳定性大小;②最高价氧化物对应水化物的酸性强弱;③非金属单质间的置换反应。
答案:可以说明氯元素非金属性比硫元素强的主要实验事实有:①氯气与氢气反应时光照可发生爆炸,反应剧烈,硫单质加热变为蒸气才可与H2化合,且H2S不如HCl稳定;②H2SO4的酸性不如HClO4强;③H2S与Cl2反应可生成硫单质;④铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS。
S、Cl两原子电子层数相同,但Cl原子最外层电子数较多,且Cl原子半径比S原子小,最外层电子受原子核的引力较大,故氯元素非金属性应比硫元素强。
点评:结构决定性质,本题意在运用以前所学的知识,来指导元素化合物知识的学习,以此来加深对原子结构和元素周期律知识的理解。
[例2]含有硒(Se)的保键品已进入市场,已知该元素与氧具有相同的最外层电子数。则下列关于硒的叙述中不正确的是
A.最高价氧化物的化学式为SeO3
B.单质Se是一种半导体材料
C.原子半径比硫大,比溴小
D.单质的氧化性比氯气弱,比溴强,比O3弱
解析:本题解题的关键在于搞清楚Se与O、S、Cl、Br等元素在元素周期表中的相对位置关系及Se单质和臭氧的特殊性质。如Se可作为半导体材料,臭氧是很强的氧化剂等。另外元素周期律的知识是判断选项正误的钥匙。
Se位于元素周期表的第ⅥA族,最外层为6个电子,故最高价为+6价,最低价为-2价,因此最高价氧化物的形式为SeO3。再由于Se原子半径较S原子的大,故体现部分金属性质。硒可作为半导体材料。因此选项A、B都正确。
根据O、S、Cl、Br与Se在元素周期表中的相对位置关系,运用元素周期律的知识不难判断出原子半径大小关系为:Se>S、Se>Br;单质的氧化性的关系为O3>O2>S>Se、Cl2>Br2>Se,因此可判断C、D两选项中的部分判断存在错误。
答案:CD

 点评:在学习元素化合物知识时,应能利用结构 性质 用途之间的相互关系,类比同族中代表性元素,抓住同周期、同主族元素性质的递变性来分析、推理未知的或不太熟悉的元素或化合物的性质,是学习元素化合物知识或解决部分信息迁移题的常见思维方法。
点评:在学习元素化合物知识时,应能利用结构 性质 用途之间的相互关系,类比同族中代表性元素,抓住同周期、同主族元素性质的递变性来分析、推理未知的或不太熟悉的元素或化合物的性质,是学习元素化合物知识或解决部分信息迁移题的常见思维方法。
[例3]0.1 mol某单质跟足量的硫充分反应后,质量增加1.6 g,则组成这种单质的元素是
A.铁 B.铜 C.铝 D.钾
解析:充分反应后,质量增加的1.6 g必为参加反应的硫的质量,则n(S)=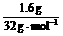
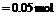 ,说明:n(单质):n(S)=0.1
mol∶0.05 mol=2∶1。分析四个选项,符合该反应物质的量之比(2∶1)的,只有Cu和K,2Cu+S
,说明:n(单质):n(S)=0.1
mol∶0.05 mol=2∶1。分析四个选项,符合该反应物质的量之比(2∶1)的,只有Cu和K,2Cu+S Cu2S,2K+S
Cu2S,2K+S K2S。
K2S。
答案:BD
点评:本题涉及到S单质的氧化性,是基础知识,但由于其氧化性相对较弱,遇到一些变价金属时,许多同学往往把握不准。通过此题,可以帮助学生掌握该知识点,同时也可培养学生思维的敏捷性和严密性。有助于同学们分析和定量处理所学化学反应能力的培养。
[例4]1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家,大气中的臭氧层可滤除大量的紫外线,保护地球上的生物,氟利昂(如CCl2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3),有关反应为:
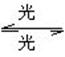
O3 O2+O Cl+O3====ClO+O2 ClO+O====Cl+O2
总反应:2O3====3O2
(1)在上述臭氧变成氧气的反应过程中,Cl是
A.反应物 B.生成物 C.中间产物 D.催化剂
(2)O2和O3之间的关系是 。
解析:回答第1题时,要注意观察总反应,此反应的反应物是O3,生成物是O2,显然选项A、B都可以立即排除,又由于反应物中不含氯元素,氯原子显然也不会是中间产物,因而选项C当然也不是本题答案。这样可判断,氯原子只能是催化剂。从给出的反应历程看,第二、三两步反应很明确地显示了氯原子在反应前后组成与质量都不变的这一特征。
因此,第1题的答案是选项D。
O3和O2都是单质,而且都是由氧元素构成的单质,只是它们的分子组成不相同,由此可见,O3和O2属于“由同种元素构成的不同单质”这一基本特征,它们应属于氧的两种同素异形体。
答案:(1)D (2)同素异形体
点评:本组试题是信息迁移试题。它引用了1995年诺贝尔化学奖授予的研究项目,并介绍了氟利昂破坏大气臭氧层的反应机理。
题目的取材较新,而且是当前环境化学中被关注的焦点之一,但是,设问的情境却不难,通过简单的思考,就会正确回答。
[例5](1994年全国)下列反应适用于实验室制备氧气的是
①高锰酸钾热分解
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
②硝酸铵热分解
2NH4NO3 4H2O+2N2↑+O2↑
4H2O+2N2↑+O2↑
③过氧化氢催化分解2H2O2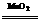 2H2O+O2↑
2H2O+O2↑
④二氧化氮热分解2NO2 2NO+O2
2NO+O2
A.只有① B.①和② C.①和③ D.①③④
解析:在本题所给出的4个反应中,除了高锰酸钾热分解反应是众所周知的实验室里氧气的制法之外,过氧化氢催化分解也可以方便地用于实验室制备氧气。为此,可将二氧化锰置于一只烧瓶内,从分液漏斗中滴入过氧化氢立即有氧气产生,并可用控制滴速的方法来调节产生氧气的气流量。
硝酸铵的热分解不能用于实验室制氧气。一方面因为温度不同硝酸铵分解的产物不同,即使发生了题目所指出的反应,生成的是氮气和氧气的混合气体,难以分离;同时,硝酸铵受热易发生爆炸,因而缺乏可靠的安全性。
NO2的热分解也显然不能用于实验室制备氧气。气体作为反应物不易控制,即使反应实现了,两种气体也不易分离,而且它们在常温下还可能化合起来再生成NO2。
答案:C
点评:一般说来,物质的实验室(尤其是在中学化学实验室里)制法所要求的条件大致为:反应尽可能快一些,反应条件尽可能简单,操作比较易行,尽量使制备的产物单一易于分离;而对反应物的成本、能耗,可以较少考虑,尽可能使用常用的仪器设备,如试管、烧瓶、烧杯等等,反应较为安全。
[例6]臭氧(O3)是一种有点腥气味的淡蓝色气体,它具有比氧气更强的氧化性。臭氧能使湿润的淀粉碘化钾试纸变蓝,反应中有氧气产生,这个反应的化学方程式是: ,这个反应的氧化产物是 ,还原产物是 。
解析:由题干信息可知这是一个牵涉由臭氧(O3)与KI发生的氧化还原反应。淀粉碘化钾试纸变蓝,说明有单质(I2)产生,产物中还同时产生氧气(O2)。由化合价分析,生成氧气的O元素价态不变,即实际并没有参加氧化反应,因此可推知起氧化作用的实际上是臭氧中的部分氧原子。被还原的氧原子在有水存在的情况下一般产物为OH-,与K+组成产物中的KOH,因此反应中还须有H2O参加反应,从而解决问题。
答案:方程式:O3+2KI+H2O====I2+O2+2KOH;氧化产物:碘单质(I2);还原产物:氢氧化钾(KOH)。
点评:本题属信息挖掘题,要善于挖掘分析题给信息,抓住“淀粉KI试纸变蓝”这一特征(暗示有I2单质生成),充分利用氧化还原的规律来解决问题。
[例7](1999年广东,25)针对以下A-D四个涉及H2O2的反应(未配平),填写空白
A.Na2O2+HCl--H2O2+NaCl
B.Ag2O+H2O2--Ag+O2+H2O
C.H2O2 H2O+O2
H2O+O2
D.H2O2+Cr2(SO4)3+KOH--K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)H2O2体现弱酸性的反应是(填代号) ,其理由为 。
解析:反应A是一个非氧化还原反应。盐酸是为人熟知的强酸,它与Na2O2反应除了生成盐以外还得到H2O2,按照“强酸可置换弱酸”的规律,在此反应中H2O2表现出弱酸的性质。
反应B中Ag2O变成单质银,可见H2O2当是一种还原剂,其中的氧元素应合理地认为转化成为氧气。至于生成物中的水,其氧元素可认为从氧化银而来。
过氧化氢的分解反应C,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性。
答案:(1)D (2)C
(3)A 这一反应可看作是强酸制取弱酸的反应
点评:本题以过氧化氢为素材,考查考生有关氧化还原的基础知识以及思维的严密性,同时考查对具体问题的分析判断能力。
4.实战演练
44.8 L。现将此条件下V1 L SO2和O2的混合气体通过装有催化剂的反应器,充分反应后(假设反应完全)气体的体积为V2 L。所得气体用含a mol的NaOH溶液吸收,恰好完全反应。当产物分别为下列三种情况时,计算并推导a的表达式(用V1,V2表示)。
(1)Na2SO4
(2)Na2SO4和Na2SO3
(3)Na2SO4和NaHSO3
16.(8分)(吉林省调研题)已知273℃,1.01×105 Pa时,1 mol气体所占的体积为
15.(6分)室温时,V L真空容器内通入n mol SO2和m mol H2S。
(1)若n=2,则当m等于多少时,反应后容器内气体的密度最小?
(2)若2n>m,则反应后氧化产物与还原产物的质量差为多少克?
(3)若5n=m,且反应后氧化产物与还原产物的质量和为48 g,则n+m的值是多少?
14.(6分)Na2SO3在空气中极易被氧化,现有a g样品,将其溶解后,
加入足量BaCl2溶液,可得干燥的沉淀b g。
(1)若Na2SO3未被氧化,b= a。
(2)若Na2SO3全部被氧化,b= a。
(3)若Na2SO3部分被氧化,b与a的关系式为 。
13.(12分)实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
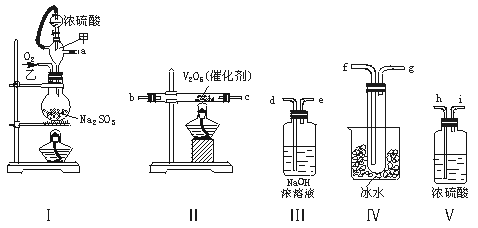
(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
12.(8分)A和B在常温下都是气体,A和B在空气中都不能被点燃,A的式量比B大。现分步实验如下:在A溶液中通入适量B气体,溶液酸性显著增强;继续加硝酸钡溶液反应,得到一种不溶于稀硝酸的白色沉淀;过滤,滤液无色;再向滤液中加入硝酸银溶液,析出另一种不溶于稀硝酸的白色沉淀。回答下列问题:
(1)写出A、B两种气体的名称:A ,B 。
(2)写出上述各步实验中的化学方程式,属离子反应的写离子方程式: 。
11.(10分)将SO2通入下列溶液中:
①氢硫酸,②溴水,③品红溶液,④澄清石灰水,⑤酸性高锰酸钾,⑥氯化钙溶液,
⑦用硝酸酸化的硝酸钡溶液,⑧硝酸钡
(1)使溶液颜色褪去的有 。
(2)先生成沉淀而后能溶解的有 。
(3)有沉淀产生不能溶解的有 。
(4)SO2作还原剂的有 。
(5)SO2作氧化剂的有 。
(6)无明显现象的有 。
10.一定物质的量的SO2与NaOH溶液反应,所得产物中含Na2SO3和NaHSO3物质的量之比为3∶5,则参加反应的SO2与NaOH物质的量之比为
A.1∶2 B.3∶5
C.8∶11 D.18∶8
9.为了除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是
①饱和Na2SO4溶液;②饱和NaHCO3;③浓硫酸;④灼热的铜网;⑤碱石灰。
A.①③④ B.②③④
C.②④③ D.③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com