
题目列表(包括答案和解析)
3、还原性:SO2使溴水和高锰酸钾溶液褪色
SO2+Br2+2H 2O=== H2SO4+2HBr
5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4
 2SO2+O2
2 SO3
2SO2+O2
2 SO3
(SO3+H2O===H2SO4,SO3是无色固体SO3是一种无色固体,熔点是16.80C,沸点也只有44.8℃,易溶于水,溶于水时放出大量的热。)
2、氧化性:
SO2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现。
SO2+2H 2S===3S↓+2H 2O
1、酸性氧化物
能和碱反应生成盐和水:SO2+2NaOH===Na2SO3+H2O
能与水反应生成相应的酸:SO2+H2O===H2SO3
(二氧化硫的水溶液使紫色石蕊试液变红)
二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。
SO2+H2O H2SO3
H2SO3
SO2与CO2性质的比较
|
名称 |
CO2 |
SO2 |
|
与H2O反应 |
CO2+H2O H2CO3 H2CO3 |
SO2+H2O H2SO3 H2SO3 |
|
与碱反应 |
CO2+2NaOH===Na2CO3+H2O CO2+NaOH===NaHCO3 CO2+Ca(OH)2===CaCO3↓+H2O |
SO2+2NaOH===Na2SO3+H2O SO2+NaOH===NaHSO3 SO2+Ca(OH)2===CaSO3↓+H2O |
|
与盐反应 |
CO2+CaCO3+H2O===Ca(HCO3)2 |
CaSO3+SO2+H2O===Ca(HSO3)2 |
无色、有刺激性气味的有毒气体;
密度比空气大;
易溶于水(1∶40);(可用于进行喷泉实验,如SO2、HCl、NH3)
易液化(-10℃)
36、向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充分反应后,收集到2.24L(标准状况)气体。过滤残留固体,干燥后称重,质量比加入的锌粉减轻了7.5g求:
(1)加入的铜片的质量。
35、为检验一瓶Na2SO3是否变质以及变质的程度,取a g干燥试样,用适量蒸馏水配成溶液后,加入足量BaC12溶液,再将沉淀经过滤、洗涤、干燥、称量,得固体bg。
(1)若a = _________ (填入含b的代数式),说明试样未变质;
若a =_________ (填入含b的代数式),说明试样已全部变质;
若_________ (填入a、b的关系式),说明试样部分变质。
(2)若取10g试样,假定Na2SO3已有50%(指物质的量)变质,则上述b值应为_________。
34、粉笔是教室内空气的主要污染源,粉笔的生产过程可图示如下:
(1)A的化学式是____________________,步骤②所发生反应的化学方程式是________________________________________
(2)已知甘油是一种能与水以任意比互溶的有机物。在A中加入少量甘油和纯碱,可制成“无尘”粉笔。加入甘油能减少粉尘,这是利用甘油能与
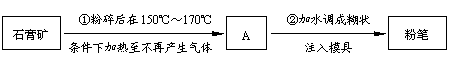
水以任意比例互溶,吸湿性很强,粉笔中含甘油可使粉笔末因潮湿而不易漂浮的性质。加入纯碱可提高硬度,写出与此相关的化学方程式:_____________________________。
33、实验证明:Cu不能在常温下与O2反应,也不能与稀硫酸共热发生反应。但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制CuSO4的,铜屑在此条件下被溶解的化学方程式为_______________________ _____________。利用Cu制备CuSO4的另一种方法可用化学方程式表示为_______________________。以上两种方法________者好(填“前”、“后”),原因是_____________________________。
32、已知98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸溶液的物质的量浓度为
A.9.2mol/L B.大于9.2mol/L C.小于9.2mol/L D.不能确定
31、将m%的硫酸与3m%的硫酸等体积混合,得到的硫酸溶液的质量分数为x%,则下列关系正确的是
A.x=2m B. x<2m C.x>2m D.m<x<2m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com