
题目列表(包括答案和解析)
6、有A、B、C、D、E五种主族元素,其原子的最外层电子数依次为1、2、7、6、4,原 子序 数按E、B、C、A、D的顺序依次增大.D的最高价氧化物的式量与气态氢化物的式量之比为1. 57∶1,且该原子核内有45个中子,A、B、C原子的次外层都有8个电子,E原子的次外层有2 个电子.
(1)计算D的原子量 ;
(2)画出D的原子结构示意图 ;
(3)写出元素符号:A 、B 、C 、D 、E ;
(4)按酸性由强到弱、碱性由弱到强的顺序写出它们最高价氧化物对应水化物的化学式 ;
5、下表标出的是元素周期表的一部分元素,回答下列问题:
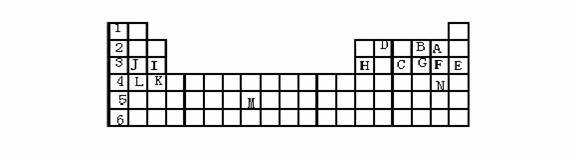
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 。
4、短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A. 原子半径A<B<C B .A的氢化物的稳定性大于C的氢化物
C. B的氢化物的熔点比A氧化物高 D. A与C可形成离子化合物
3、A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A .A、B、C、D、E B. E、C、D、B、A
C. B、A、D、C、E D. C、D、A、B、E
下列叙述正确的是
A.同周期元素的原子半径为ⅦA族的为最大
B.在周期表中零族元素的单质全部是气体
C.A、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
2、下列说法中错误的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
4.实战演练
3. 例题精讲
例1今有A、B、C、D、E五种短周期元素,它们的核电荷按 C、A、D、E的顺序增大。C、D都能分别与A按原子个数比1:1或2:1形成化合物。CB可与EA2反应生成C2A与气态物质EB4。
⑴写出五种元素名称A B ,C ,D , E 。
⑵画出E的原子结构简图 ,写出电子式D2A2 , EB4 。
⑶比较EA2与EB4的熔点高低 < 。
⑷写出D单质与CuSO4溶液反应的离子方程 。
[解析]此题的关键在于分析EB4中E元素只能是ⅣA族元素C或Si。因B 的原子序数不最小,则B不可能为H元素,E的价态应为+4,B应为ⅦA族元素,且只能为F,如果无Cl元素,则原子序数比E还大。而E只能为Si,即EB4为SiF4, 从CB的化合物的形式可知C为+1价,则由C2A可知A为-2价,只能为O。能与O按原子个数比1:1或2:1形成化合物的元素只能是H或Na。
[答案]⑴氧,氟,氢,钠,硅 ⑵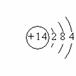 略
略
⑶ SiO2 >SiF4
⑷ 2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑
[命题意图]本题考查主族元素的化合价与原子序数的关系,以及有关元素周期表中各关系式的具体应用。
例2砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物不可能具有的性质是
A. HAt很稳定 B. 易溶于某些有机溶剂
C. AgAt不溶于水 D. 是有色固体
[解析]由题意,砹在周期表中与碘相邻,故它的性质与碘具有相似性,但它的非金属性应比碘弱。HAt的稳定不如HI,故选项A错误;碘易溶于某些有机溶剂,则砹也应溶解;AgI不溶于水,则AgAt也不溶于水;碘是紫黑色固体,根据相似性砹也是有色固体。
本题正确选项为A。
例3:两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数可能是哪些? (1)m-4;(2)m+4;(3)m+8;(4)m-2;(5)m+6。 在解题中应首先根据抽象化学式XY3确定X、Y可能的化合价 XY3或XY3,依据X、Y可能的化合价找到它们在周期表中的位置 X位于ⅢA族或ⅤA,Y位于ⅦA或ⅠA,再根据它们在周期表中位置推断出具体元素进行组合,这样从抽象的化学式XY3落实到具体实例:BF3、AlF3、BCl3、AlCl3、NH3、PH3。此时要注意思维的严谨性,记住特殊实例:PCl3、SO3。最后再用具体实例代替抽象的XY3,逐一进行核对得出X可能的原子序数,以上答案均可能。 此类型题的特点主要集中在短周期元素的范围内进行讨论,有时还强调属于离子型或共价型化合物,主要考查思维的敏捷性和全面性。短周期元素两两形成化合物的类型与实例归纳如下:
|
类型 |
AB |
AB2 |
A2B |
AB3 |
A2B3 |
A3B2 |
|
离子型 |
ⅠA与ⅦA |
ⅡA与ⅦA |
ⅠA与ⅥA |
ⅢA与ⅦA |
ⅢA与ⅥA |
ⅡA与ⅤA |
|
共价型 |
H与ⅦA |
ⅣA与ⅥA |
H与ⅥA |
H与ⅤA |
B与ⅥA |
|
|
特例 |
CO、NO |
SO2、NO2 |
N2O |
PCl3、SO3 |
N2O3 |
|
例4:X、Y是除第一周期外的短周期元素,它们可以形成离子化合物XmYn,且离子均具有稀有气体原子的结构,若X的原子序数为a,则Y 的核电荷数不可能是: A.a+8-m-n B.a+16-m-n C.a-m-n D. a-8+m+n 根据化学式XmYn推算X、Y两元素的化合价分别为+n、-m,此时所形成的阳离子Xn+和阴离子Ym-均具有稀有气体原子的结构,所对应的稀有气体原子有以下三种情况:同一种原子,则有a-n=b+m;相差一周期,则a-n+8=b+m;相差两周期,则a-n+16=b+m。故答案D错误。 例5:若短周期中的两元素可以形成原子个数比为2:3的化合物,则两种元素的 原子序数之差不可能是: A.1 B.3 C.5 D.6 根据题意,两元素可形成A2B3型化合物,A为+3价即为ⅢA族的Al或B及ⅤA族的N或P;可形成-2价的元素为ⅥA族的O或S。ⅢA、ⅤA族元素的原子序数为 奇数,ⅥA族元素的原子序数为偶数,因此其差值不可能为偶数,故答案应选D。 此题利用了短周期元素的主族序数与原子序数的关系:主族序数为奇数则原子序数为奇数;主族序数为偶数则原子序数为偶数。
3.周期表中部分规律总结
⑴最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He除外)。
⑵在周期表中,第ⅡA与ⅢA族元素的原子序数差别有以下三种情况:①第1-3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差15。
⑶每一周期排布元素的种类满足以下规律:设n为周期序数,则奇数周期中为 种,偶数周期中为
种,偶数周期中为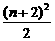 种。
种。
⑷同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅣA-ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
⑸设主族元素族序数为a,周期数为b,则有:①a/b<1时,为金属元素,其最高氧化物为碱性氧化物,最高氧化物对应的水化物为碱;②a/b=1时,为两性元素(H除外),其最高氧化物为两性氧化物,最高氧化物对应的水化物为两性氢氧化物;③a/b>1时,为非金属元素,其最高氧化物为酸性氧化物,最高氧化物对应的水化物为酸。无论是同周期还是同主族元素中,a/b的值越小,元素的金属性越强,其最高氧化物对应水化物的碱性就越强;反之,a/b的值越大,元素的非金属性越强,其最高氧化物对应水化物的酸性就越强。
⑹元素周期表中除第Ⅷ族元素以外,原子序数为奇(或偶)数的元素,元素所在族的序数及主要化合价也为奇(或偶)数。
⑺元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般既有金属性,也有非金属性。
⑻对角线规则:沿周期表中金属与非金属分界线方向对角(左上角与右下角)的两主族元素性质相似,这一规律以第二、三周期元素间尤为明显。



 1.位、构、性三者关系
1.位、构、性三者关系
结构决定位置,结构决定性质,位置体现性质。
2.几个量的关系
周期数=电子层数
 主族数=最外层电子数=最高正价数
主族数=最外层电子数=最高正价数
 |最高正价|+|负价|=8
|最高正价|+|负价|=8
17.晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。FexO晶体结构如下图所示。已知FexO晶体密度ρ为5.71 g·cm-3,晶胞边长为4.28×10-10 m。(铁相对原子质量为55.9,氧相对原子质量为16)
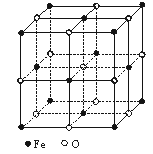
求:(1)FexO中x值。
(2)晶体中的铁分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占的质量分数(用小数表示精确到0.001)。
(3)确定此晶体的化学式(化学式中表示出Fe2+和Fe3+的个数)。
(4)在该晶体中,铁元素的离子间的最短距离为多少米?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com