
题目列表(包括答案和解析)
1、硝酸的实验室制法
硝酸有挥发性,所以在实验室里可以把硝酸盐跟浓硫酸共同加热来制取。反应为:
 NaNO3+H2SO4(浓) △ NaHSO4+HNO3↑
NaNO3+H2SO4(浓) △ NaHSO4+HNO3↑
装置图:
注意:加热时最好微热。因为HNO3受热易分解。制得的硝酸常略显黄色,是因为溶有少量NO2的缘故。
2、硝酸的氧化性
硝酸是一种很强的氧化剂,不论稀硝酸还是浓硝酸都有氧化性。硝酸越浓氧化性越强。
同浓度的硝酸温度越高氧化性越强。硝酸能氧化除Pt、Au之外的绝大多数金属,还能氧化许多非金属(如碳、硫、磷),及具有还原性的物质(如H2S、Na2SO3、SO2、HBr、HI、Fe2+、Sn2+,松节油、锯未等)。如:
铜、汞、银等不活泼金属与浓硝酸剧烈反应,一般认为生成硝酸盐和二氧化氮而与稀硝酸反应通常需加热,产生金属硝酸盐和一氧化氮,在反应中硝酸均既表现氧化性又表现酸性。
Cu+4HNO3(浓)= Cu (NO3)2+2NO2↑+2H2O ……………………①
 3Cu+8HNO3(稀) △ 3Cu (NO3)2+2NO↑+4H2O …………………②
3Cu+8HNO3(稀) △ 3Cu (NO3)2+2NO↑+4H2O …………………②
上述两反应均可用离子方程式表示为:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
3 Cu+4H++2NO3-=2Cu3++2NO↑+4H2O
值得注意的是切不可以还原产物的价态来判断硝酸氧化性的强弱,必须肯定浓硝酸氧化性强于稀硝酸氧化性。同时必须切实知道反应中作为氧化剂的硝酸的物质的量等于产生气体(氮的氧化物)的物质的量,即使产生NO2和NO的混合气体亦是如此。
 反应①可用作实验室制取NO2气体,用平底烧瓶分液漏斗、双孔塞组合实验装置,由于反应剧烈,可控制滴加浓硝酸的速率控制产生NO2的速率,只能用向上排空气法收集NO2气体,多余的NO2气体可用碱液吸收。该制取应在通风橱中进行。反应②可作为实验室制取NO的反应,装置选择固+液 △ 气的装置,只能用排水法收集。
反应①可用作实验室制取NO2气体,用平底烧瓶分液漏斗、双孔塞组合实验装置,由于反应剧烈,可控制滴加浓硝酸的速率控制产生NO2的速率,只能用向上排空气法收集NO2气体,多余的NO2气体可用碱液吸收。该制取应在通风橱中进行。反应②可作为实验室制取NO的反应,装置选择固+液 △ 气的装置,只能用排水法收集。
铝、铁遇冷的浓硝酸产生钝化现象,即浓硝酸将它们表面氧化成一层薄而致密的氧化物薄膜、阻止了进一步反应的缘故。
铁在过量的浓硝酸中加热发生反应为:



 Fe+6HNO3(浓) △ Fe (NO3)3+3NO2↑+3H2O
Fe+6HNO3(浓) △ Fe (NO3)3+3NO2↑+3H2O
过量的铁在稀硝酸中发生反应为:
3Fe+8HNO3(稀) △ 3Fe (NO3)2+2NO↑+4H2O
活泼金属跟稀硝酸反应,由于金属的强还原性,还原产物较为复杂。例如:4Mg+10HNO3(稀)=4Mg (NO3)2+NH4NO3+3H2O。
王水(浓硝酸和浓盐酸体积比)能使Pt、Au溶解。
碳、硫、磷等非金属单质在热而浓的硝酸中剧烈反应:
C + 4HNO3(浓) △ CO2↑+4NO2↑+2H2O
 S + 6HNO3(浓) △ H2SO4+6 NO2↑+4H2O
S + 6HNO3(浓) △ H2SO4+6 NO2↑+4H2O
 P + 5HNO3(浓) △ H3PO4+5 NO2↑+H2O
P + 5HNO3(浓) △ H3PO4+5 NO2↑+H2O
 P4 + 20HNO3(浓) △ 4H3PO4+20 NO2↑+4H2O
P4 + 20HNO3(浓) △ 4H3PO4+20 NO2↑+4H2O
某些还原性的化合物能被硝酸氧化:
3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O
3H2S+2HNO3=3S+2NO+4H2O
 2NaBr+4HNO3(稀)△ 2NaNO3+2NO2↑+Br2↑+H2O
2NaBr+4HNO3(稀)△ 2NaNO3+2NO2↑+Br2↑+H2O
6KI+8HNO3(稀)=6KNO3+I2+2NO↑+4H2O
硝酸溶于水发生完全电离:HNO3=H++NO3-,常用浓硝酸中,硝酸也是以离子形成存
在于水溶液中,因此硝酸具有酸的通性。硝酸是一种强酸,除具有酸的通性外还有它本身的特性。
1、硝酸的不稳定性
 4e
4e
 4HNO3 △ 2H2O+4NO2↑+O2↑
4HNO3 △ 2H2O+4NO2↑+O2↑
或光照
硝酸的浓度越大越易分解,温度越高分解越快,光越强分解越快。为了防止硝酸的分
解,必须把它盛在棕色瓶里密封贮放在黑暗而且温度低的地方。常用浓硝酸略带黄色,是因为少部分硝酸分解而产生的NO2气体溶解在硝酸中的缘故。
如果将浓硝酸加热分解产生的气体收集起来再溶于水时,该混合气可被水完全吸收,无残留气体。这是因为收集到的气体中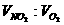 =4:1溶于水时,发生反应:4NO2+O2+2H2O=4HNO3,恰好均被完全吸收。
=4:1溶于水时,发生反应:4NO2+O2+2H2O=4HNO3,恰好均被完全吸收。
纯净硝酸是无色、易挥发,有刺激性气味的液体,密度比水大。因为它的晶体为分子
晶体,所以它的熔沸点较低。因为硝酸分子为强极性分子,所以它能以任意比溶于水。常用浓硝酸的质量分数大约是69%。98%以上的浓硝酸叫“发烟硝酸”。浓硝酸为挥发性酸,打开瓶盖露置于空气中,瓶口上方观察到白雾。
8、A、B、C、D、E五种物质都含有同一种元素,其中D在常温下为无色有刺激性气味的有毒气体,在一定条件下有如图所示的转化关系:
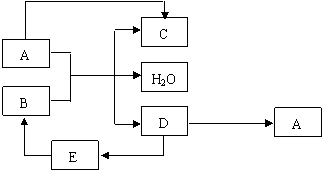
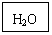
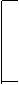

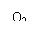

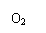
填写以下空白:
(1)A、B、C、D、E五种物质中共同元素原子的电子式为 。
(2)A、B反应的化学方程式为 。
(3)工业上制取气体D的化学方程式为 。
(4)如何检验A中是否含有C?简述所用试剂的先后顺序。
7、
 已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
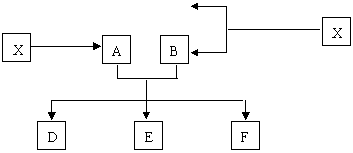






(1)写出①、②、③步所有反应的化学方程式
(2)设③步所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6L,试计算取用的每份X中FeO和CuO的质量比。
6、 某校课外兴趣小组用下图所示过程除去AlCl3中含有的Mg2+、Ca2+杂质离子。试根据图中编号确定对应物质的分子式或化学式。
某校课外兴趣小组用下图所示过程除去AlCl3中含有的Mg2+、Ca2+杂质离子。试根据图中编号确定对应物质的分子式或化学式。
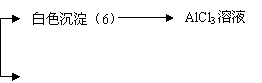





 Al3+
Al3+

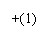 Ca2+
Ca2+
 Cl-
Cl-
 Mg2+
Mg2+
(1) ;(2) ;(3) ;(4) ;
(5) ;(6) ;(7) 。
5、 A是中学化学中常见无机物,A、B、C中含同一种元素R,不含R的产物已略去,如下图所示主要反应关系:
A是中学化学中常见无机物,A、B、C中含同一种元素R,不含R的产物已略去,如下图所示主要反应关系:


 ①A与NaOH溶液反应,既可生成B又可生成C,
①A与NaOH溶液反应,既可生成B又可生成C,
 还可以生成B和C,若A为氧化物,则A的化学
还可以生成B和C,若A为氧化物,则A的化学
式(写出两种) 、 ;若A为
气态氢化物,B中含有A中两种元素,试写出C与稀硫酸反应生成A的离子方程式 ;若A为一种铝盐,则B、C的化学式分别为 、 。
②若A的单质与NaOH溶液无论何种物质的量之比反应,产物必为B和C,设R元素在化合物A、B、C中的化合价分别为x、y、z,则x、y、z必须满足的关系是 。
4、下图中A是一种正盐,D比C的相对分子质量大16,E是酸,不论X是强酸还是强碱时,都有如下转化关系:
当X是强酸时,A、B、C、D、E均含有同一种元素
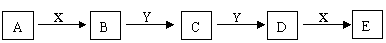
当X是强碱时,A、B、C、D、E均含另一种元素
用化学式回答下列问题:
①A是 Y是 Z是
②当X是强碱时,E是 A与X反应的离子方程式为
③当X是强酸时,E是 A与X反应的离子方程式为
3、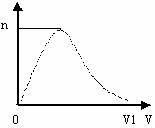
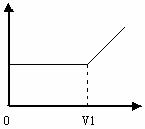 由H2和Cl2组成的混合气体,经光照充分反应后,通入100ml
1.0mol/LNaOH溶液中,图甲表示溶液中某种离子的物质的量随通入气体体积的变化曲线,图乙表示溶液的电导性随通入气体体积的变化曲线,请分析、推断并填空:
由H2和Cl2组成的混合气体,经光照充分反应后,通入100ml
1.0mol/LNaOH溶液中,图甲表示溶液中某种离子的物质的量随通入气体体积的变化曲线,图乙表示溶液的电导性随通入气体体积的变化曲线,请分析、推断并填空:


①图甲表示溶液中 离子的变化曲线;
②对溶液进行导电实验,当通入的混合气体体积大于V1时引起溶液导电性明显增强的主要阴、阳离子是 ;
③当n=0.01mol时,光照前的混合气体中H2与Cl2的物质的量之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com