
题目列表(包括答案和解析)
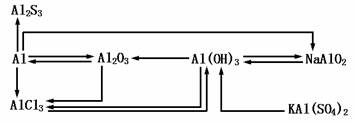
3.试剂的滴加顺序不同产生的现象不同
(1)NaOH和AlCl3
向AlCl3溶液中滴加NaOH溶液,先出现白色沉淀后消失:
Al3++3OH-=Al(OH)3 ↓ Al(OH)3+OH-=AlO2-+2H2O
向NaOH溶液中滴加AlCl3溶液,开始无现象后出现白色沉淀:
Al3++4OH-= AlO2-+2H2O Al3++3AlO2-+6H2O=4Al(OH)3↓
(2)NaAlO2和盐酸
向NaAlO2溶液中滴加盐酸,先出现白色沉淀后消失:
NaAlO2+HCl+H2O= Al(OH)3↓+NaCl Al(OH)3+3H+=Al3++3H2O
向盐酸中滴加NaAlO2溶液,开始无现象后出现白色沉淀:
4HCl+NaAlO2= NaCl+AlCl3+2H2O AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
(3)Na2CO3和盐酸
向Na2CO3溶液中滴加盐酸,开始无现象,后产生气泡
Na2CO3+HCl=NaCl+NaHCO3 NaHCO3+HCl=NaCl+H2O+CO2↑
向盐酸中滴加Na2CO3溶液,立即产生气泡
Na2CO3+2HCl=2NaCl+H2O+CO2↑
2.两性物质与物质的两性
两性物质指即能与酸反应,又能与碱作用生成盐和水的化合物,如Al2O3、ZnO、Zn(OH)2、Al(OH)3、氨基酸、蛋白质等。
物质的两性,如强碱弱酸盐(NaHCO3、KHS、Na2HPO4等)弱酸弱碱盐(CH3COONH4、NH4HS)等,既能与强酸反应,又能与强碱作用,但只能说这种物质的性质有两性,不能将它们称为两性物质,因为这些化合物不是由本身直接电离出的H+和OH-参加反应,并且生成物不全是盐和水。
Al既能与酸作用,又能与强碱溶液反应,但不属于两性物质,也不能说它具有两性,因为Al与强碱溶液反应的本质是:2Al+6H2O=2Al(OH)3+3H2↑,Al(OH)3+NaOH=NaAlO2+2H2O,两式相加为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由以上反应可知:Al不直接与NaOH溶液反应,Al仍然为金属元素。
Al(OH)3具有两性,是两性物质,可用电离平衡移动的原理来解释:Al(OH)3的电离方程式可表示如下:
AlO2-+H++H2O≒Al(OH)3≒Al3++3OH-
其电离程度相当微弱,只有加入强酸(或强碱)时,大量的H+(或OH-)才能破坏Al(OH)3的电离平衡,使平衡向右(或左)移动,生成铝盐(或偏铝酸盐),所以Al(OH)3即具有碱性,又具有酸性。当加入弱酸或弱碱时,因H+(或OH-)浓度太小,不能使上述平衡移动,因此Al(OH)3只溶于强酸或强碱,而不溶于弱酸或弱碱(如碳酸、氨水)。
Al3+只能在酸性溶液中大量存在,如AlCl3、Al2(SO4)3溶液均是酸性溶液;铝元素在碱性溶液中能以AlO2-离子大量存在,所以AlO2-与OH-、Al3+与H+ 不能大量共存,AlO2-与Al3+也不能大量共存,其离子方程式是:Al3++3AlO2-+6H2O=4Al(OH)3↓。
1.在学习过程中一定要注意以下几点:
(1)注重理论知识的指导作用,培养思维能力.如学习镁、铝性质时,可用元素周期表及周期律的理论为指导;在学习Al(OH)3两性时,可运用电离理论和化学平衡理论进行分析.这样不仅可以巩固所学的理论知识,还可以培养自己分析问题解决问题的能力.
(2)温故知新,培养自己归纳总结的能力.如铝的一些性质在初三和高一曾学习过.要在复习有关知识的基础上学完本节后学会总结、归纳的方法,使所学的知识系统化、网络化.
(3)充分发挥主体作用,培养自学能力.如金属的通性、合金等内容通过自学,不仅可以获得知识,更重要的是学会读书的方法,培养自学能力.
(4)掌握图像题的解题技巧,如Al(OH)3两性的计算.
4.Mg(OH)2与Al(OH)3的比较
|
|
Mg(OH)2 |
Al(OH)3 |
|
|
物理 性质 |
均为白色固体,不溶于水 |
||
|
化 学 性 质 |
不稳定性 Mg(OH)2=MgO+ H2O |
不稳定性 2Al(OH)3=Al2O3+3H2O |
|
|
碱性 Mg(OH)2+2H+=Mg2++H2O |
两性Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O |
||
|
制 备 |
Mg2++2OH-=
Mg(OH)2↓ Mg2++2NH3·H2O =Mg(OH)2↓+2NH4+ |
Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 不用强碱 AlO2-+CO2+2H2O= Al(OH)3↓+HCO3- 不用强酸 |
|
3.MgO与Al2O3的比较
|
|
MgO |
Al2O3 |
|
物理 性质 |
均为白色粉末,不溶于水, 熔点高(MgO>Al2O3),是优良的耐火材料 |
|
|
化 学 性 质 |
与热水反应 MgO+H2O=Mg(OH)2 |
与水不反应 |
|
碱性氧化物 MgO+2H+=Mg2++H2O |
两性氧化物 Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O |
2.铝及其化合物转化关系
1.镁及其化合物转化关系
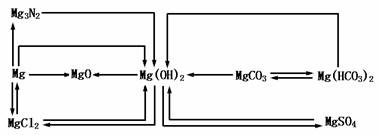
3.镁、铝在自然界中均以化合态存在,铝是地壳里存在最多的金属元素。工业上用电解熔融的MgCl2制取Mg,用电解熔融的Al2O3制取Al。
2.铝热剂、铝热反应
某些金属氧化物粉末,与铝粉混合后在较高温度下剧烈反应生成Al2O3和其它金属并放出大量的热的反应,叫铝热反应。
能作铝热剂的不只是Fe2O3,还可以是V2O5、Cr2O3、MnO2等与Al粉形成铝热剂,铝热反应较多的应用于生产上,如:焊接钢轨,熔炼难熔金属V、Cr等。
|
金属 项目 |
镁(Mg) |
铝(Al) |
|
原子结构 |
|
|
|
原子半径 |
1.60×10-10m |
1.43×10-10m |
|
化合价 |
+2 |
+3 |
|
晶体结构 |
金属晶体 |
金属晶体 |
|
单质 |
物理 性质 |
镁和铝都是密度较小、熔点较低、硬度较小的银白色金属,但镁和铝相比较,铝的硬度比镁的稍大,熔点和沸点都是铝比镁的高 |
|
活泼性 |
较活泼:Mg-2e=Mg2+ |
较活泼:Al-3e=Al3+ |
|
抗腐 蚀性 |
在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有搞腐蚀性能 |
|
|
与O2反应 |
点燃 2Mg+O2 = 2MgO |
△ 4Al+3O2 = 2Al2O3 |
|
与酸 反应 |
Mg+2H+=Mg2++H2↑ |
2Al+6H+=Al3++3H2↑ |
|
与碱 反应 |
不反应 |
2Al+2OH-+2H2O=2AlO2-+3H2↑ |
|
与氧化物反应 |
点燃 2Mg+CO2 = 2MgO+C |
△ 2Al+Fe2O3=Al2O3+2Fe |
|
结论 |
镁、铝均为较活泼的金属,但镁的金属性强于铝 |
|
|
解释 |
核电荷数镁小于铝,而原子半径镁大于铝,故核对最外层的电子引力镁小于铝,即Al比Mg难失电子,金属性弱于Mg |
|
|
主要 用途 |
镁合金汽车、飞机制造、照明弹等 |
铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等 |
1.我们要善于从镁和铝的原子结构、晶体结构的相同和相似的一面认识它们性质的相似性;从结构上不同的一面提示和把握它的性质上相异性以及递变。
镁和铝都是较活泼的金属。在一定条件下,它们都可以和水反应,置换出水中的氢。镁跟冷水便缓慢地反应,加热时反应更为显著。铝和沸水也能微弱的反应,但现象不明显。这一方面是因为镁的金属活动性较铝相对较强,另一个不可忽视的原因是它们的氢氧化物虽然都难溶于水,但Mg(OH)2较Al(OH)3的溶解性相对较大,所以与水反应时生成的Mg(OH)2在镁条表面的覆盖要小,尤其是在加热的条件下(加热时水中的氢离子浓度也相对较大)。但在像在NaOH溶液的强碱性条件下,情况就不一样了。在强碱溶液中,Mg(OH)2的溶解度大为减小,水中的氢离子浓度也减小了,事实证明,镁和强碱溶液不反应,而铝则不然,由于Al(OH)3是典型的两性氢氧化物,它可溶于强碱溶液。即:
Al(OH)3+OH-=AlO2-+2H2O
由上分析可知:铝是一种较活泼的金属,它并不能直接与碱反应,而是先与水反应,2Al+6H2O=2Al(OH)3+3H2↑……①
生成的Al(OH)3是典型的两性氢氧化物,它溶于强碱
Al(OH)3+NaOH=NaAlO2+2H2O……②
将两反应按①+②×2合并,即得总反应方程式:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
所以在上述反应中铝是还原剂,而氧化剂是H2O,不是NaOH。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com