
题目列表(包括答案和解析)
3.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
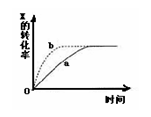
2SO2(g)+O2(g) 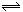 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1molSO2(g)
B.保持温度和容器内压强不变,充入1molAr(g)
 C.保持温度和容器内压强不变,充入1molO2(g)
C.保持温度和容器内压强不变,充入1molO2(g)
D.保持温度和容器内压强不变,充入1molSO3(g)
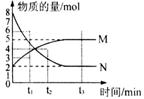
2.在一定温度下,一定体积的密闭容器中有如下平衡: H2(g) + I2(g) 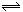 2HI(g)
2HI(g)
已知H2和I2的起始浓度均为0.10 mol/L时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L,则平衡时H2的浓度(mol/L)是 ( )
A.0.02 B.0.04 C.0.08 D.0.16
1.下列事实不能用勒夏特列原理解释的是: ( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工厂通常采用20MPa-50MPa压强,以提高原料的利用率;
C.在实验室里,可用碳酸钙粉末和稀硫酸制得二氧化碳气体;
D.实验室用排饱和食盐水的方法收集氯气。
4. (1)一定温度下,容器内某一化学反应中M、N
(1)一定温度下,容器内某一化学反应中M、N
的物质的量随反应时间的变化的曲线如右图,则此反应的化学方程式为 ;此反应达到平衡时反应物的转化率 。
(2)在10℃和2×105pa的条件下,反应:aA(g)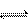 dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),表中列出不同压强下反应建立平衡时物质D的浓度。(已知反应过程中未出现物态变化。)
dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),表中列出不同压强下反应建立平衡时物质D的浓度。(已知反应过程中未出现物态变化。)
|
压强/pa |
2×105 |
4×105 |
|
D的浓度(mol/L) |
0.7 |
1.5 |
则压强由2×105增大到4×105时,平衡向 方向移动(填“正”或“逆”)。a与(d+e)的关系是:a (d+e)。(填“大于”、“小于”或“等于”。)
3.有mA(g)+nB(g) 3C(g)平衡体系,在不同条件下,反应混合物中A、B、C的体积分数和时间t的关系如图所示:
3C(g)平衡体系,在不同条件下,反应混合物中A、B、C的体积分数和时间t的关系如图所示:
(1)若图A的a和b两条曲线分别表示有无催化剂的情形,曲线 表示有催化剂的情形。
(2)若图B中c、d两条曲线分别表示不同温度的情形,则曲线 表示高温时的情形。
(3)若图C中e、f表示不同压强时的情形,则曲线 表示压强较大时的情形,方程式中A、B两种物质的系数m、n分别为 、 。
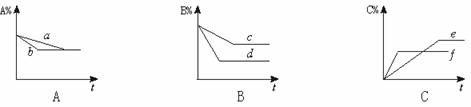
2.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
 (1)请计算前20秒内氧气的平均生成速度: ;
(1)请计算前20秒内氧气的平均生成速度: ;
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂
(其他条件都不变),请在图上用虚线
画出加化剂后的反应进程曲线。
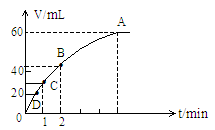
1.加入0.1mol 粉末于50mL的
粉末于50mL的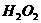 中(密度
中(密度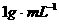 )在标准状况下放出的气体体积与时间的关系如图所示:
)在标准状况下放出的气体体积与时间的关系如图所示:
(1)实验时放出的气体总体积是 。
(2)反应放出-半气体所需时间是 。
(3)反应放出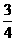 气体所需的时间约为 。
气体所需的时间约为 。
(4)A、B、C、D各点批反应速率快慢的顺序是 。
(5)解释上述A、B、C、D快慢的原因是 。
4.反应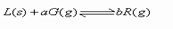 达到平衡时,温度和压强对该反应的影响如图所示,图中:
达到平衡时,温度和压强对该反应的影响如图所示,图中: ,x轴表示温度,y轴表示平衡混合气中G的体积分数。有下列判断:(1)该反应是放热反应; (2)该反应是吸热反应; 3)a>b; (4)a<b;其中正确的是
( )
,x轴表示温度,y轴表示平衡混合气中G的体积分数。有下列判断:(1)该反应是放热反应; (2)该反应是吸热反应; 3)a>b; (4)a<b;其中正确的是
( )
A. (1)(3) B. (1)(4) C. (2)(3) D. (2)(4)
3.右图曲线a表示放热反应X(g)+Y(g) 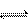 Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
( )
A.升高温度 B.加大X的投入量
 C.加催化剂 D.增大体积
C.加催化剂 D.增大体积
2.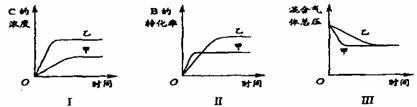 在容积固定的密闭容器中存在如下反应: A(g)+3B(g)
在容积固定的密闭容器中存在如下反应: A(g)+3B(g)  2C(g); △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g); △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是 ( )
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图I研究的是压强对反应的影响,且乙的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com