
题目列表(包括答案和解析)
13.某石油液化气由丙烷和丁烷组成,其质量分数分别为80%和20%。它们燃烧的热化学方程式分别为:C3H8(g)+5O2(g)==3CO2(g)+4H2O(1);△H=-2200kJ/mol;
C4H10(g)+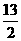 O2(g)==4CO2(g)+5H2O(1);△H=-2900kJ/mol。有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗液化石油气0.056kg,试计算该燃料的利用率。[已知水的比热为4.2kJ/(kg·℃),铝的比热为0.88kJ/(kg·℃)]
O2(g)==4CO2(g)+5H2O(1);△H=-2900kJ/mol。有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗液化石油气0.056kg,试计算该燃料的利用率。[已知水的比热为4.2kJ/(kg·℃),铝的比热为0.88kJ/(kg·℃)]
答案:50%
评析:1.0kg石油气完全燃烧释放的热量为: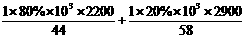 =5×104kJ
=5×104kJ
将水烧开所需热量为:Q=cm(t-t0)=(4.2×4.0+0.88×0.80)×(100-20)=1 400(kJ)
所以,燃料的利用率为: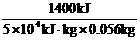 ×100%=50%
×100%=50%
12.已知下列热化学方程式的热效应:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H1=-26.7kJ/mol
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H2=-50.75kJ/mol
(3)Fe3O4(s)+CO(g)=3FeO(s)十CO2(g);△H3=-36.5kJ/mol
不用查表,计算下列反应的△H。FeO(s)+CO(g)=Fe(s)+CO2(g)
答案:7.28kJ/mol
评析:由盖斯定律得所求方程的反应热为{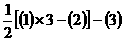 }/3。
}/3。
11.(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为 。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为
;又知H2O(l)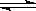 H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
(3)已知A、B两种气体在一定条件下可发生反应:2A+B==C+3D+4E。现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成;在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×106Pa,又测得反应共放出QkJ热量。试根据上述实验数据写出该反应的热化学方程式____________________________________________。
答案:(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136kJ/mol
(2)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165kJ/mol 1016.5kJ
(3)2A(g)+B(g)==C(g)+3D(l)+4E(g);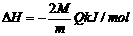
评析:(3)中由反应前后的压强之比为3:5可推测反应后D的状态为液态。
10.一些盐的结晶水合物,在温度不太高时就有熔化现象,既熔溶于自身的结晶水中,又同时吸收热量,它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点℃ |
40~50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/相对分子质量) |
49.7 |
37.3 |
77.0 |
100.1 |
(1)上述潜热材料中最适宜应用的两种盐是______、________________。
(2)实际应用时最常用的(根据来源和成本考虑)应该是_____________。
答案:(1)Na2SO4·10H2O、Na2HPO4·12H2O (2)Na2SO4·10H2O
评析:熔点越低,越有利于盐吸收太阳能而熔化,故排除Na2S2O3·5H2O。进一步比较单位质量吸热效率:
|
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
0.17kJ/g |
0.24kJ/g |
0.28kJ/g |
很明显,Na2SO4·10H2O、Na2HPO4·12H2O吸收率较高。又因前者比后者价廉而易获得。实际应选用Na2SO4。
9.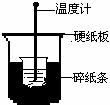 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________;用50mL0.50mol/LNaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________(均填“偏大”、“偏小”或“无影响”)。
答案:(1)环形玻璃搅拌器 (2)减少实验过程中热量损失 (3)偏小 (4)不相等,相等,因为中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱用量无关 (5)偏小 偏小
8.已知热化学方程式H+(aq)+OH-(aq)==H2O(1);△H=-57.3kJ/mol,问:
(1)常量滴定用0.025L0.10mol/L的强酸和强碱互相中和,则滴定过程中释放的热量为_________________kJ。
(2)若中和后溶液体积为0.05L,又已知中和后的溶液的比热容为4.2×10-3kJ/(g·℃),且密度为1.0g/mL,则溶液温度升高_____________℃。
(3)由(2)说明为什么需要用0.5mol/L-1mol/L的强酸和强碱反应测定中和热?
答案:(1)0.14 (2)0.7 (3)根据(2)的计算可知,当溶液的浓度过小,释放的热量较少,且又是逐渐产生热量,故测定的中和热误差较大。若浓度过高,则溶液中阴、阳离子间的相互牵制较大,中和过程产生热量的一部分将补偿未电离分子离解所需要的热量,同样会造成较大的误差。
7.已知下列几种烷烃的燃烧热如下:
|
烷 烃 |
甲烷 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
己烷 |
|
燃烧热/(kJ·mol-1) |
890.3 |
1559.8 |
2219.9 |
2877.0 |
3536.2 |
4163.1 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480KJ。
(1)试写出乙烷气体燃烧的热化学方程式_______________;
(2)计算该天然气中甲烷的体积分数___________________;
(3)由上表可总结出的近似规律是_____________________;
(4)根据(3)的近似规律可预测癸烷的燃烧热约为_________kJ·mol-1。
答案:(1)2C2H6(g)+7O2(g)==4CO2(g)+6H2O(l);△H=-3119.6kJ/mol
(2)72.13% (3)烷烃分子中每增加一个CH2燃烧热平均增加645kJ/mol左右 (4)6776
烧的热化学方程式中水为液态的水。
6.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-282.5kJ/mol。假如标准状况下由CH4、CO、CO2组成的89.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中CO占的体积百分含量约为
A.40% B.50% C.60% D.70%
答案:B
5.将白磷隔绝空气加热到260℃可转变为红磷。以下说法正确的是 ( )
A.白磷转变为红磷是一个吸热过程 B.红磷比白磷稳定
C.白磷转变为红磷需外界提供引发反应的能量 D.白磷比红磷稳定
答案:BC
4.热化学方程式:S(g)+O2(g)=SO2(g);△H=-297.3kJ/mol,分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(l);|△H|>297.3kJ/mol B.1molSO2的键能总和大于1molS和1molO2键能之和
C.S(g)+O2(g)=SO2(l);|△H|<297.3kJ/mol D.1molSO2的键能总和小于1molS和1molO2键能之和
答案:AB
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com