
题目列表(包括答案和解析)
2.铁在金属的分类中属于黑色金属,重金属,常见金属。纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。还原铁粉为黑色粉末。
1. 铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:
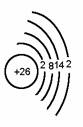 主要化合价:+2,+3
主要化合价:+2,+3
15.(10分)有CuO和木炭粉的混合物4.24 g,在高温条件下充分反应后,剩余固体混合物呈红色,质量为3.36 g;若反应产生的气体能全部被过量的澄清石灰水吸收,得沉淀2 g,试通过计算指出所得固体产物的组成及质量分数。
14.(8分)为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52 g样品,将其全部溶于过量稀硝酸后,配成100 mL溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66 g固体。在余下的50 mL溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。
(1)计算磁性粉末材料中氧元素的质量分数。
(2)确定该材料的化学式。
13.(12分)下图是一个实验示意图,方框表示有关的仪器,箭头表示液体或气体的流向
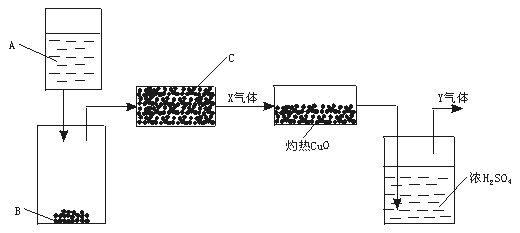
图中A是液体,B、C是固体。A与B反应后产生的气体经过C,得到纯气体X。X通过灼热CuO,CuO转化为Cu。气体再通过浓H2SO4,最后得到纯气体Y,Y是对环境没有污染的气体,大量排放也没有危险。
为进行以上实验,请从下列试剂范围内选择合适的A、B和C:浓硫酸、稀硫酸、浓硝酸、稀硝酸、浓盐酸、稀盐酸、锌粒、浓NaOH溶液、大理石、碱石灰、NH4Cl固体。
(1)A是 ,B是 ,C是 ,X是 。
(2)写出A和B,X和CuO反应的化学方程式 。
12.(12分)(1996年全国高考题)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
填写下列空白:
(1)实验进行时试管A中应加入的试剂是 ;
烧瓶B的作用是 ;
烧瓶C的作用是 ;
在试管D中收集得到的是 。
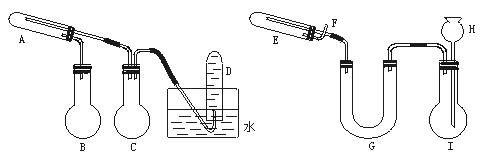
(2)实验时,U型管G中应加入的试剂是 ;长颈漏斗H中应加入 。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) 。
(4)烧瓶Ⅰ中发生的反应有时要加入少量硫酸铜溶液,其目的是 。
(5)试管E中发生反应的化学方程式是 。
(6)为了安全,在E管中的反应发生前,在F出口处必须 ;E管中的反应开始后,在F出口处应 。
11.(8分)制FeO常用下法:
FeC2O4 FeO+CO↑+CO2↑
FeO+CO↑+CO2↑
试说明不采用FeCO3加热分解制FeO而用此法制FeO的原因。
10.质量相等的CaO2和CaO两份样品,前者与后者所含氯元素的质量比是
A.2∶1 B.7∶9
C.14∶9 D.9∶7
9.下列叙述正确的是
A.含金属元素的离子不一定是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
8.我国的稀土矿含量丰富,稀土元素可用RE表示。在提纯过程中可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀,反应为:
RE2(SO4)3+Na2SO4+xH2O RE2(SO4)3·Na2SO4·xH2O(x=1,2)下列有关叙述正确的是
RE2(SO4)3·Na2SO4·xH2O(x=1,2)下列有关叙述正确的是
A.该反应一定在强碱溶液中进行
B.产生沉淀的反应为复分解反应
C.反应生成的沉淀属于复盐
D.产生沉淀的变化属于化学变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com