
题目列表(包括答案和解析)
5.某有机物在氧气中完全燃烧时,其蒸气与消耗的氧气及生成的二氧化碳在同温同压下的体积比为1∶4∶3,该有机物不可能是( )
A.C3H4 B.C3H8O2 C.C3H6O D.C3H6O2
4.充分燃烧等质量的下列各组有机物,在相同条件下需O2的体积不完全相同的一组是( )
A.乙炔、苯 B.乙醇、甲醚(CH3-O-CH3)
C.丙炔、异丙苯 D.环丙烷、丙醇
3.充分燃烧等物质的量的下列有机物,在相同条件下需要氧气最多的是( )
A.C4H8O2 B.C4H10 C.C2H6O2 D.C2H2
2.1.01×105Pa,120℃时,某气态烃在密闭容器中与过量O2混和点燃,完全反应后,保持温度,压强不变,体积增大的是( )
A.CH4 B.C2H6 C.C3H4 D.C2H2
1.常温常压下,等质量的以下各烃分别在足量的O2充分燃烧,消耗O2最多的是( );等物质的量的下列各烃分别在足量O2中充分燃烧,消耗O2最多的是( )
A.甲烷 B.乙烯 C.丙炔 D.丁烷
0.56∶22.4=1.1∶x 0.56∶22.4=0.9∶y
x=44(g) y=36(g)
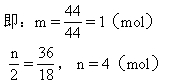
该烃分子式为CH4.其分子空间结构示意图为
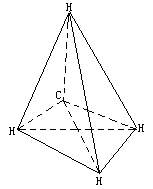
解法3:
该烃摩尔质量=0.717×22.4=16(g/mol),只能是有机物中相对分子质量最小的CH4.
[答案](略).
[例10] 标准状况下4.48L某烯烃和CO的混合气体与足量的氧气混合点燃,使之反应,将反应完毕后生成的气体通过浓硫酸,浓硫酸增重7.2g,并测得剩余气体中CO2为11.2L(标准状况),求此烯烃分子式.
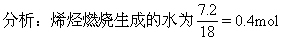
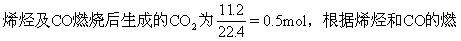 烧方程式列方程求解.
烧方程式列方程求解.
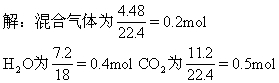
设混气中烯烃为xmol,则CO为(0.2-x)mol.
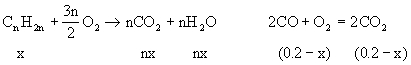
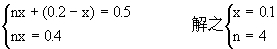
答案:烯烃分子式为C4H8.
[例11] 某有机物的蒸气完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的CO2,该有机物可能是 [ ].
A.C2H4 B.C2H5OH C.CH3CHO D.CH3COOH
分析:首先判断为C2化合物,但无助于选择,因为4个选项均是C2化合物,故关键是利用耗氧量进行选择.关于耗氧量的选择有两种解法求解.
解法一 用通式求解.由:
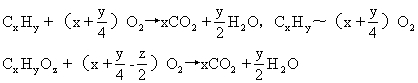
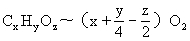
得:A.C2H4-3O2 B.C2H5OH-3O2

解法二 用“氢二氧一可内消”原则求解.关于(B)、(C)、(D)三项,均是烃的含氧衍生物,不必用常规关系式CxHyOz-(x+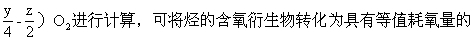
CxHy(z可为0),即:(B)C2H5OH-C2H4(C)CH3CHO-C2H2(D)CH3COOH-C2
答案:AB
[例12] mg的饱和一元醇,在氧气中完全燃烧后,产生14.4g水和13.44L(标准状况下)二氧化碳气体.
(1)试确定该醇的化学式.
(2)m的值是多少?
分析:根据mg饱和一元醇燃烧后产生的水和CO2的量可分别求得mg饱和一元醇中H和C的物质的量,二者之比正好等于饱和一元醇通式CnH2n+2O中2n+2与n的比,于是可求得n值,从而就能确定其化学式.再根据化学式和其燃烧方程式及产生CO2或水的差,就能求出m的值.
(1)设饱和一元醇的化学式为CnH2n+2O

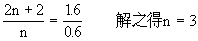
该饱和一元醇的化学式为C3H8O.
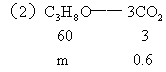
60∶m=3∶0.6 m=12
答案:(1)C3H8O
(2)m=12
实战演练
1.1g x 0.9g y
44∶1.1=12∶x 18∶0.9=2∶y
x=0.3(g) y=0.1(g)
烃中C、H元素原子个数比
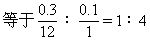
该烃实验式为CH4,式量为16.
该烃相对分子质量=0.717×22.4=16
该烃分子式为CH4,其分子空间结构示意图见下一解法的解题过程.
解法2:
设该烃为CmHn.此烃1mol完全燃烧生成CO2和H2O分别为xg和yg.
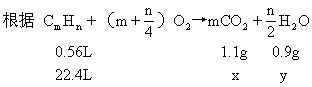
3.商余法:根据碳氢化合物中对其相对分子质量碳、氢原子的影响大小,用碳相对原子质量除以相对分子质量,所得商的整数部分就是烃分子中所含碳原子数的最大值,而余数就是氢原子数的最小值.注意从 为CH4
为CH4
[例7] 某烃1.68g,完全燃烧生成CO25.28g和H2O2.16g,经测定这种烃在标准状况下的密度为3.75g/L则其分子式是 [ ]
A.CH4 B.C3H8 C.C4H10 D.C6H12
分析:本题是计算推断分子式的又一种类型,就是利用烃的完全燃烧反应方程式列出比例式求解类型.设烃分子式为CxHy,则有
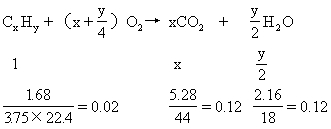
解得 x=6 y=12
答案: D.
[例题8] 2.3g某有机物A完全燃烧后,生成0.1molCO2和2.7g H2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式.
分析:根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身.因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断.该有机物的相对分子质量,则可以利用实验测出的相对密度来求.
(1)求2.3g该有机物中组成元素的质量:
C: C --→ CO2
12 44
m(C) 44g/mol×0.1mol
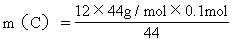
=1.2g
H: 2H --→ H2O
2 18
m(H) 2.7g
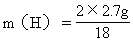
=0.3g
m(C)+m(H)=1.2g+0.3g=1.5g<2.3g
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量(2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:
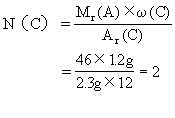
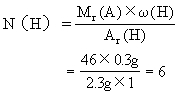
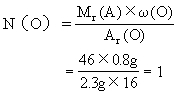
答案:该有机物的分子式是C2H6O.
[例9] 标准状况下,密度为0.717g/L的某气态烃0.56L,在足量氧气中充分燃烧,反应后的气体先通过无水氯化钙,氯化钙增重0.9g;再通过氢氧化钠溶液,溶液增重1.1g.通过计算判断此气态烃的分子式,并画出其分子空间结构的示意图.
分析:本题是在已知有机物完全燃烧时,涉及的有关物质量关系,判断其分子组成的典型定量计算题.其解法有三种.
第一种解法是通过该烃燃烧生成的CO2和H2O的量,即本题中燃烧生成气体经过NaOH溶液和无水氯化钙后,两者增重的量,计算出烃中的C、H元素的质量比,进而求得实验式.再根据题中该气态烃在标准状况下的密度,求得其相对分子质量.最后由实验式和相对分子质量.判断它的分子组成.然而本题所给数据,求得实验式为CH4.依据烃的分子组成中,C原子个数为n时,H原子的最多个数不大于(2n+2)个的规律,即可确定此实验式就是所求的分子式.
第二种解法是通过烃的燃烧通式:
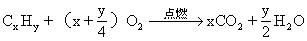
计算该烃1mol完全燃烧时,生成CO2和H2O物质的量,从而求得烃分子中C、H元素原子个数,求得其分子式
第三种解法是由本题特点决定的解法特例.即通过该烃在标准状况下的气体密度、计算相对分子质量为16.而相对分子质量为16的烃,是相对分子质量最小的甲烷,其分子式为CH4.
如上各解法均可求得该烃为甲烷,就可画出表示甲烷分子空间结构的正四面体分子构型.
答案:
解法1:
设该烃中C、H元素的质量分别为x、y g.
根据题意和题中数据:
CO2 - C H2O - 2H
44g 12g 18g 2g
2.最简式法:根据已知先求出摩尔质量,再据质量分数求出碳氢原子个数比,然后找到最简式式量与相对分子质量的关系,最后确定分子式. M=8×2=16
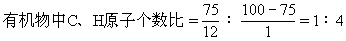
所以最简式为CH4 其式量=16
设分子式为(CH4)n
因为最简式式量=相对分子质量
所以分子式就是最简式,即为CH4
1.基本方法:先根据测得的气体密度计算气体的摩尔质量,然后计算1mol气态有机物中各元素原子的物质的量,最后确定该气态有机物的分子式.M=8×2=16

所以该有机物的分子式为CH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com